(1)氯化铝水溶液呈 性(填“酸性”,“中性”或“碱性”),原因是(用离子方程式表示): 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是(写化学式) 。实验室在保存AlCl3溶液时,常在溶液中加少量的 ,以 (填“促进”、“抑制”)其水解。
(2)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 性(填“酸性”,“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<”)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性,(填“酸性”,“中性”或“碱性”)溶液中c(Na+) c(CH3COO-) (填“ >” 或“=”或“<”)。
(4) 物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 性,(填“酸性”,“中性”或“碱性”),醋酸体积 氢氧化钠溶液体积(填“ >” 或“=”或“<”)。
(5)已知0.1 mol·L-1的NaHCO3溶液PH=9,则溶液中c(CO32-) c(OH-) (填“ >” 或“=”或“<”),其溶液显电中性的原因 (用离子浓度关系式表示)。
在三个密闭容器内分别装有:A.Na2O2和NaHCO3,B.Na2O2和NH4HCO3,C.Na2O2和Ca(HCO3)2,其中每种物质均为1 mol。将它们加热至300℃,经充分反应后排出气体,写出各容器内残留的固体物质名称及其物质的量。A ,B ,C ,如分别加入相同浓度的足量稀H2SO4与残留物完全反应,则消耗硫酸的体积从大到小的顺序依次为 。
苏打和小苏打有着广泛应用,试从反应物用量角度说明,在下列用途中选(A)苏打,还是(B)小苏打,并说明原因。
(1)做面条时防止面粉较长时间储存变酸味,常加入适量的碱面,选用________,因为________。
(2)作为泡沫灭火器的药品,选用________,因为________。
(3)用于洗涤餐具及实验室的玻璃仪器等,选用________,因为________(提示:二者水溶液均显碱性,且苏打的碱性强)。
(4)治疗胃酸过多时,选用________,因为________。
A、B、C、D、E五种物质都含有同一元素,它们按下图所示关系相互转化,已知A为单质。
(1)写出A~E的化学式
(2)分别写出有关反应的化学方程式,其中属于氧化还原反应的,请标出电子转移的方向和数目
①A→B:________②A→C:________③A→D:________
④C→D:________⑤C→E:________⑥D→E:________
工业上为了处理含有Cr2O72-的酸性工业废水,采用下列的处理方法:是绿矾(FeSO4·7H2O),把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。其主要的化学方程式如下:
H2Cr2O7+6FeSO4+6 H2SO4=Cr2(SO4)3+3Fe 2(SO4)3+7H2O
现用上述方法处理1×104L含铬(+6价)78mg/L的废水(Cr相对原子质量为52),请回答下列问题:
⑴处理后,沉淀物中除Cr(OH)3外,还有.(用化学式表示)。
⑵需用绿矾的质量。
FeS饱和溶液中存在溶解平衡:FeS(s)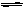 Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
Fe2+(aq)+S2-(aq),常温下Ksp = [Fe2+]·[ S2-]=8.1×10-17 mol2/L2。由此请回答:
⑴理论上FeS的溶解度为。
⑵又知FeS饱和溶液中[H+]与[ S2-]之间存在着如下关系:[H+]2·[ S2-]=1.0×10-22 mol3/L3,为了使溶液里[Fe2+]达到了1mol/L,现将FeS适量投入到其饱和溶液中,应调节溶液中的[H+]为。