(8分) 实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①中碳酸氢铵受热(100℃以上)可分解生成氨气、水和二氧化碳的混合气,该混合气的平均摩尔质量为 。(数值保留到小数点后一位)
(2)操作②为什么不能改为加硝酸钡溶液?__________________________________。
(3)操作③的目的是__________________________________(结合化学方程式回答)。
(4)操作④的目的是____________________________________________________。
环己酮是一种重要的有机化工原料。实验室合成环己酮的反应如下: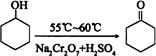
环己醇和环己酮的部分物理性质见下表:
| 物质 |
相对分子质量 |
沸点(℃) |
密度(g·cm—3、20 ℃) |
溶解性 |
|
| 环己醇 |
100 |
161.1 |
0.9624 |
能溶于水和醚 |
|
| 环己酮 |
98 |
155.6 |
0.9478 |
微溶于水,能溶于醚 |
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯。其主要步骤有(未排序):
A.蒸馏、除去乙醚后,收集151℃~156℃馏分
B.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
C.过滤
D.往液体中加入NaCl固体至饱和,静置,分液
E.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分提纯步骤的正确顺序是。
(2)b中水层用乙醚萃取的目的是。
(3)从下关于萃取分液操作的叙述中,不正确的是。
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图用力振荡
B.振荡几次后需打开分液漏斗上口的玻璃塞放气
C.经几次振荡并放气后,手持分漏斗静置液体分层
D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作D中,加入NaCl固体的作用是。蒸馏除乙醚的操作中采用的加热方式为。
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是。
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是。
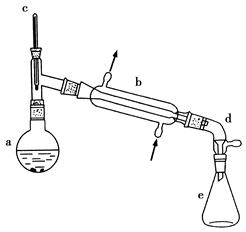
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下: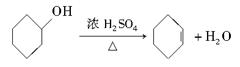
可能用到的有关数据如下:
| 相对分子质量 |
密度 g/cm3 |
沸点/℃ |
溶解性 |
|
| 环己醇 |
100 |
0.9618 |
161 |
微溶于水 |
| 环己烯 |
82 |
0.8102 |
83 |
难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________。
(2)加入碎瓷片的作用是________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________。
(4)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶B.温度计 C.吸滤瓶D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是________(填正确答案标号)。
A.41%B.50% C.61%D.70%
菠菜营养丰富,长期以来民间流传着“菠菜不能与豆腐同食”的说法。某学校化学兴趣小组的同学拟通过实验探究:菠菜是否含有草酸类物质?草酸又有哪些性质?通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,草酸晶体(H2C2O4·2H2O)的熔点为100.1℃,在175℃时受热分解,草酸钙是难溶于水的白色固体。
他们设计的实验步骤如下:
1.将菠菜在少量开水中煮沸2~3 min,冷却后滤去菠菜,得滤液(含有少量CO32—杂质)。向滤液中加入足量Ca(OH)2溶液,然后再加入足量CH3COOH溶液,观察现象。
2.用草酸晶体(H2C2O4·2H2O)做以下实验:
请回答以下问题:
(1)步骤1中加入CH3COOH溶液的作用:___________________
(2)A处应选择________(填“Ⅰ”或“Ⅱ”),在做实验之前,应先____________________。
(3)实验2过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中草酸晶体(H2C2O4·2H2O)发生反应的化学方程式:______________,装置B的作用是___________________。
(4)为使实验结论更加严密和安全,在以上所连接的装置C、D间还需依次添加装有________、________、________(液体试剂)的洗气瓶,此外指出上述装置中的不足之处还有________。
制备氮化镁的装置示意图如下: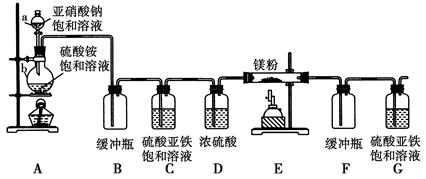
回答下列问题:
(1)检查装置气密性的方法是__________________________,
a的名称是________,b的名称是________。
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式________________________________。
(3)C的作用是________,D的作用是________,是否可以把C与D的位置对调并说明理由________。
(4)写出E中发生反应的化学方程式____________________。
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现象___________________________________
某同学设计实验以探究元素性质的递变规律,实验装置如图所示。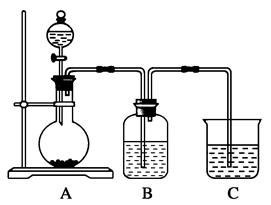
实验Ⅰ:根据元素最高价含氧酸的酸性强弱探究元素非金属性递变规律。
已知A装置的烧瓶里装有大理石,分液漏斗里装有稀HNO3,B装置中装有饱和碳酸氢钠溶液,装置C中装有Na2SiO3溶液,试回答:
(1)A中反应的离子方程式为____________________,C中可观察到的现象是________。
(2)B装置的作用是__________________________________________________________。
(3)根据实验现象推知,碳酸、硝酸、硅酸的酸性强弱顺序是________,由此得出碳、硅、氮三种元素非金属性的强弱顺序是________。
实验Ⅱ:已知常温下高锰酸钾与浓盐酸混合可产生氯气,利用该装置探究氯和溴元素的非金属性强弱。
(4)写出B装置中发生反应的离子方程式:_______________________________________。
(5)C装置的作用是_________________________________________________________。
(6)实验结论:氧化性:____________________,非金属性:____________________。