利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知:2SO2(g)+O2(g)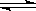 2SO3(g)△H=-196 kJ·mol-1。
2SO3(g)△H=-196 kJ·mol-1。
(1)该反应的平衡常数表达式为K= ;某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
| A.保持温度和容器体积不变,充入1.0 mol O2 |
| B.保持温度和容器内压强不变,充入1.0 mol SO3 |
| C.降低温度 |
| D.移动活塞压缩气体 |
(4)若以下图所示装置,用电化学原理生产硫酸,写出通入SO2电极的电极反应式 。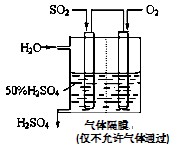
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为____ __。
(1)盖斯是热化学的奠基人,于1840年提出盖斯定律,利用这一定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。
已知:N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1。
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式:
。
(2)已知:N≡N的键能是946kJ·mol-1,H—H的键能为436kJ·mol-1,N—H的键能为393kJ·mol-1,计算合成氨反应生成1molNH3的△H=kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为___________________
②加水稀释100倍,所得溶液中由水电离出c(OH-)=_____________________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<” ,下同)。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈,溶液中c(Na+)c(CH3COO-).
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈,醋酸体积氢氧化钠溶液体积。
(每空2分,共10分)
(1)阿司匹林是一种常用的治感冒药,也是第一个重要的人工合成药物,其结构简式如图,回答下列问题:
①则其分子式为______________________。
②口服阿司匹林后,在胃肠酶的作用下,1mol阿司匹林与1mol的水发生水解反应,生成1molA和1molB两种物质。其中A的结构简式如下图所示,则A物质与乙醇能发生______反应(填“加成”或“取代”)。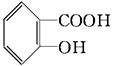
③如果服用阿司匹林出现水杨酸中毒,应立即停药,并静脉滴注________________溶液(填名称)
(2)维生素C的化学式为C6H8O6,结构如下图所示。
人体缺乏维生素C易得坏血症,所以维生素C又称抗坏血酸。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到溶液的蓝色消失,说明维生素C具有性。
(1)某病人在注射青霉素之前,一定要做。
(2)抗酸药物的种类很多,某品牌抗酸药的主要成分有糖衣、碳酸氢钠、碳酸镁、氢氧化铝和淀粉等化学物质。写出该抗酸药发挥功效时碳酸氢钠与胃酸反应的离子方程式:。写出氢氧化铝与胃酸反应的化学方程式。
(3)下表是某橙汁饮料包装袋上的说明:
| 品名 |
浓缩橙汁 |
| 配料 |
水、糖、鲜橙浓缩液、柠檬酸、维生素C、β-胡萝卜素、苯甲酸钠等 |
| 鲜橙原汁含量 |
≥20% |
| 净含量 |
1.5L |
| 生产日期 |
标于瓶盖上 |
配料中能提供能量的营养素是,
国家严格限制该橙汁饮料中防腐剂(填物质名称)的含量。
糖类、油脂、蛋白质都是人体必需的营养物质。
(1)油脂被摄入人体后。在酶的作用下水解为高级脂肪酸和____________(写名称),进而被氧化生成二氧化碳和水并提供能量,或作为合成人体所需其他物质的原料。
(2)氨基酸是组成蛋白质的基本结构单元,其分子中一定含有的官能团是和_______________(写结构简式或名称)。人体中共有二十多种氨基酸,其中人体自身______________(填“能”或“不能”)合成的氨基酸称为人体必需氨基酸。
(3)淀粉在淀粉酶的作用下最终水解为葡萄糖(C6H12O6),部分葡萄糖在体内被氧化生成二氧化碳和水。
写出葡萄糖在体内被氧化的化学方程式:。
(每小题4分,共12分)
(1)氨水和稀盐酸反应后的溶液呈中性,反应后所得溶液中的离子浓度大小关系是___。
(2)Na2CO3溶液中,其离子浓度从大到小关系为。
(3)有pH为13的Ba(OH)2、NaOH的混合溶液100mL,从中取出25mL用0.025mol/L H2SO4滴定,当滴至沉淀不再增加时,所消耗的酸的体积是滴定至终点所耗酸体积的一半.则原混合溶液中Ba(OH)2的物质的量浓度。