将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式为___________ __。
又已知:H2O(g)=H2O(l) ΔH2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
已知X是中学化学中常见的盐,其溶液呈蓝色。构成化合物F的两种元素的原子均可形成与氖原子相同电子层结构的离子,化合物F具有强氧化性。M是常见的金属单质,固体E为红棕色,是常用的颜料。N的氧化物可作为耐火材料。D与H都为气体,且两者相遇会出现红棕色。各物质的转化关系如图所示(部分 反应产物已略去)。
反应产物已略去)。
(1)将M丝插入盛有X溶液的试管中,反应一段时间后的现象是____________________。
(2)写出反应②的离子反应方程式:_________________________________________。
(3)D的化学式为________;X的化学式为________;F的电子式为_____。
(4)用石墨作电极电解1 L X溶液,电解一段时间后,将阴极取出,洗涤、干燥、称量,电极增重3.2 g。则阳极的电极反应式为____________________________________,
电解后溶液的pH为________(假设电解前后溶液体积不变)。
( 5)反应④的离子方程式为__________________________________________
5)反应④的离子方程式为__________________________________________ ___。
___。
(6)配制A溶液时,需要加入少量的________,其目的是________________________。
(1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图所示。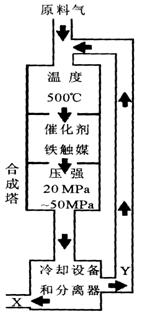
①X的化学式为;
②上图中条件选定的主要 原因是(选填字母序号);
原因是(选填字母序号);
A.温度、压强对化学平衡影响B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
③改变反应条件,会使平衡发生移动。下图表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是(选填字母代号),当横坐标为温度时,变化趋势正确的是(选填字母序号)。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应
,
②氨水中水电离出的c(OH-) 10-7mol/L(填写“>”、“<”或“=”);
③将相同体积、相同物质的量浓度的氨水和盐酸混合后,溶液中离子浓度由大以小依次为。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成A和B两种物质。A为铵盐,B在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96L氨气(标准状况),同时生成0.3molA。
①写出氨气和氟气反应的化学方程式;
②在标准状况下,每生成1 mol B,转移电子的物质的量为mol。
以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G。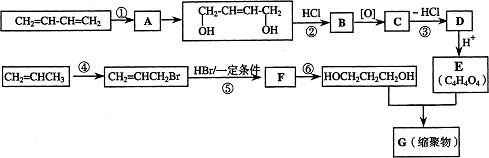
请完成下列各题:
(1)写出反应类型:反应①,反应④。
(2)写出反应条件:反应③,反应⑥。
(3)反应②③的目的是:。
(4)写出反应⑤的化学方程式:。
(5)B被氧化成C的过程中会有中间产物生成,该中间产物可能是(写出一种物质的结构简式),检验该物质存在的试剂是。
(6)写出G的结构简式。
芳香族化合物A广泛存在于植物中,具有光敏性、抗菌和消炎作用。经实验测定,A由碳、氢、氧三种元素组成,相对分子质量小于200,其中碳、氢元素的质量分数之和为78.1%。经红外光谱测定,在A的结构中存在C=O双键和C−O单键,不含O−H。A经下列步骤转变为乙二酸和水杨酸。
已知:(1)Mr(B)=Mr(A)+18,Mr(C)=Mr(B)+14;[Mr(X)表示物质X的相对分子质量]
(2)CH3CH2CH=CHCH3 CH3CH2COOH+CH3COOH
CH3CH2COOH+CH3COOH
请回答下列问题:
(1)请写出A的分子式 ▲;
(2)写出“A —→ B反应”的化学方程式: ▲;
“D —→水杨酸”的反应类型是 ▲。
(3)在上述转化过程中,设计反应步骤“B—→ C”的目的是 ▲。
(4)聚乙二酸丁二醇酯(PBSA)是目前正在实用化的生物降解性塑料之一,可以用于生产食品容器及包装材料。请写出乙二酸与1,4-丁二醇(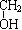 CH2CH2
CH2CH2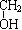 )反应合成PBSA的化学方程式: ▲。
)反应合成PBSA的化学方程式: ▲。
(5)化合物D有多种同分异构体,其中一类同分异构体具有如下特点:
①苯的二取代物,且其苯环上的一氯代物有两种。
②能发生银镜反应,与氯化铁溶液发生显色反应。
请写出这类同分异构体的任意两种结构简式: ▲。
一种“人工固氮”的新方法是在光照条件下,N2在催化剂表面与水蒸气发生反应生成NH3和氧气。已知:
| 化学键 |
N≡N |
H—O |
N—H |
O=O |
| 键能/kJ·mol-1 |
945 |
463 |
391 |
498 |
(1)请根据以上信息,写出“人工固氮”新方法的热化学方程式:_____▲______;
(2)进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ |
30 |
40 |
50 |
| 生成NH3量/(10-6mo1/L) |
4.8 |
5.9 |
6.0 |
①50℃时从开始到3 h内以O2物质的量浓度变化表示的平均反应速率为 ▲;
②与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议(请写出两条) ▲、 ▲;
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工业流程如下: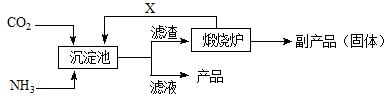
①往沉淀池中装入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是
▲。
②煅烧炉中产生的固态副产品为 ▲,生产流程中能被循环利用的物质X为 ▲。