一定条件下,将SO2和O2充入一密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题: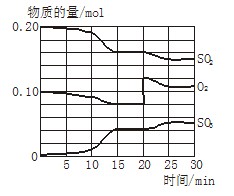
(1)降低温度,SO2的转化率_______,化学反应速度____ 。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是__ _______。
(3)反应进行至20 min时,曲线发生变化的原因是_____ _________________(用
文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
有机化合物的结构简式可进一步简化,如:
写出下列物质的分子式:
A、B、C三元素原子的核外电子数都比氩原子少, A和C处于同主族,两者间隔一周期, A元素和B元素的原子两者核电荷数之差为5, B原子核外第3电子层比第2电子层少两个电子,则B的原子结构示意图为______;A离子的结构示意图为_____;B与C形成化合物的化学式是_____,它的电子式是 它属于 化合物(填“离子”或“共价”);A与B形成化合物的化学式是 ,它的电子式是 ,它属于 化合物。
氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g) ===2H2O(l);ΔH=-572kJ/mol请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和。
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量572 kJ (填“>”、“<”或“=”)。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示,a、b两个电极均由多孔的碳块组成。它是将 能转化为 能的装置。
(每空2分共8分)A、B、C、D、E五种芳香族化合物都是某些植物挥发性油的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:请回答下列问题:
(1)这五种化合物中,互为同分异构体的是________。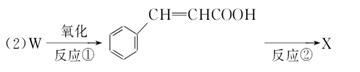
反应①采取了适当措施,使分子中烯键不起反应。以上反应式中的W是A~E中的某一化合物,则W是________;X是D的同分异构体,X的结构简式是________;(已知反应②属于加成反应)。1mol B与足量浓溴水反应,消耗mol Br2。
(共10分) G 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成: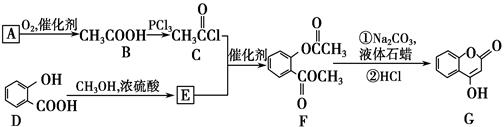
(1)A与银氨溶液反应有银镜生成,则A的分子式是________。
(2)B―→C的反应类型是________。
(3)C与E反应生成F的化学方程式________________________________
(4)F的一种同分异构体能水解且苯环上的一氯代物有一种,任意写出其中一种的结构简式________。
(5)写出F和过量NaOH溶液共热时反应的化学方程式:
__________________________________________________________。(2分)
(6)下列关于G的说法正确的是________。
a.能与金属钠反应
b.1 mol G最多能和5 mol氢气反应
c.分子式是C9H6O3
d.1molG最多和3molNaOH反应