下列变化过程,属于放热反应的是( )
① 液态水变成水蒸气 ② 酸碱中和反应 ③ 浓H2SO4稀释
④ 固体NaOH溶于水 ⑤ H2在Cl2中燃烧 ⑥ 弱酸电离
| A.②③④⑤ | B.②③④ | C.②⑤ | D.①③⑤ |
下列各项的叙述中都包含两个数值,前一数值大于后一数值的是
| A.H2S中的分子间作用力和H2O中的分子间作用力 |
| B.只含σ键的化合物和含有π键的化合物 |
| C.1mol石墨中碳碳单键的个数和1mol金刚石中碳碳单键的个数 |
| D.氨分子中N—H键的极性和甲烷分子中C—H键的极性 |
下列物质性质的变化规律,与共价键的键能大小有关的是
| A.F2、Cl2、Br2、I2的熔点、沸点逐渐升高 |
| B.HF、HCl、HBr、HI的热稳定性依次减弱 |
| C.金刚石的硬度、熔点、沸点都高于晶体硅 |
| D.醋酸易溶于水,而乙烷易溶于四氯化碳 |
氮化硼是一种新合成的结构材料,它是超硬、耐磨,耐高温的物质,下列各组物质熔化时所克服的粒子间的作用与氮化硼熔化时所克服的粒子间作用相同的是
| A.硝酸钠和金刚石 | B.晶体硅和水晶 |
C.冰和干冰 |
D.苯和酒精 |
下列说法中正确的是:①所有基态原子的核外电子排布都遵循构造原理②同一周期从左到右,元素的第一电离能、电负性都是越来越大③分子中键能越大,表示分子拥有的能量越高④所有的配合物都存在配位键,所有含配位键的化合物都是配合物⑤所有含极性键的分子都是极性分子⑥熔融状态下能导电的化合 物一定是离子化合物⑦所有的原子晶体都不导电
物一定是离子化合物⑦所有的原子晶体都不导电
| A.①② | B.①⑥ | C.③④⑤ | D.⑥ |
2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺,下列关于三聚氰胺分子的说法中正确的是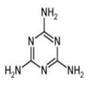
| A.一个分子中共含有15个σ键 |
B.所 有碳原子采用sp2杂化,所有氮原子采用sp3杂化 有碳原子采用sp2杂化,所有氮原子采用sp3杂化 |
| C.属于极性分子,故极易溶于水 |
| D.形成的晶体熔点较高 |