肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为_________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H =-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-534. 0kJ·mol-1
2NO2(g) N2O4(g) △H =-52.7kJ·mol-1
N2O4(g) △H =-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,写出反应的离子方程式为_ __。
(4)如图所示,A是由易导热材料制成的体积不变的密闭容器,B是一耐化学腐蚀且易于传热的体积可变的透明气囊(体积改变过程中囊体弹力改变忽略不计)。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。
①B中可通过________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则 平均化学反应速率v(NO2)等于____________________(用含a、t的代数式表示)。
④若平衡后在A容器中再充入0.5mol NO2,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
(4分)有下列物质:①空气 ②O2 ③NaHSO4 ④氨水 ⑤CuSO4·5H2O ⑥NaOH ⑦CO2 ⑧Fe2O3 ⑨金刚石 ⑩H2SO4,请回答下列问题(请在横线上填写序号):
(1)属于混合物的有;
(2)属于酸性氧化物的有;
(3)属于碱的有;
(4)属于盐的有。
(10分)一块表面已被氧化为氧化钠的钠块17.0g,投入到50g水中,最多能产生0.20g气体,则:(1)涉及的化学方程式,
(2)钠块中钠的质量是,
(3)钠块中氧化钠的质量是,
(4)原来钠块中被氧化的钠的质量是,
(5)设所得溶液的体积为50ml,求所得溶液溶质物质的量浓度是。
(一)化学与生活
(1)良好的生态环境可以提升生活质量。
①空气污染指数API表明了空气的质量。空气污染指数主要是根据空气中、NO2和可吸入颗粒物等污染物的浓度计算出来的数值。
②下列物质可用作混凝剂是(填字母)。
a.ClO2b.FeCl3c.Ca(ClO)2
③已知,汽车尾气中的一氧化碳与一氧化氮在一定条件下反应可生成对空气无污染的物质,则该反应的化学方程式为。
(2)均衡的膳食结构可以保障身体健康。
①下列维生素中,能防治夜盲症的是,能预防佝偻病的是,能防治坏血病的是。(填字母)
a.维生素Ab.维生素Cc.维生素D
②葡萄糖在人体内被氧化,最终生成和,同时释放出能量。
(3)材料的不断发展可以促进社会进步。
①下列属于复合材料的是(填字母)。
a.石灰石b.普通玻璃c.钢筋混凝土
②ABS塑料可用于制造电视机、洗衣机的外壳,ABS塑料属于(填字母)。
a.有机高分子材料 b.无机非金属材料 c.金属材料
③制造下列物质时,不需要石灰石的是(填字母)。
a.生石灰b.水泥c.光导纤维
④黄铜的主要组成元素是铜和(填元素名称)。铁器件在潮湿的空气中会发生腐蚀(填“化学”或“电化学”),为防止铁质地下管道的腐蚀可在其表面附着(填“锌块”或“石墨”)。
(I)三氧化二铁和氧化亚铜(Cu2O)都是红色粉末.常用作颜料。已知氧化亚铜溶于稀硫酸生成Cu和CuSO4。某校化学实验小组为了探究由Fe2O3和Cu2O组成的混合物中两者物质的量相对大小,某同学认为只要取少量粉末放入足量稀硫酸中,通过观察现象即可。
(1)上述实验过程中发生的反应有(用离子方程式表示):
①Fe2O3+6H+= 2Fe3++3H2O
②③
(2)若实验中观察到溶液变为蓝色且有固体剩余,则n(Cu2O)n(Fe2O3)。(填“>”、“<”或“=”)。
(II)分别在密闭容器的两个反应室中进行如下反应:
左反应室:A(g)+2B(g) 2C(g)
2C(g)
右反应室:2Z(g) X(g)+Y(g)
X(g)+Y(g)
在反应室之间有无摩擦、可自由滑动的密封板隔断。反应开始和达到平衡时有关物理量的变化如下图所示: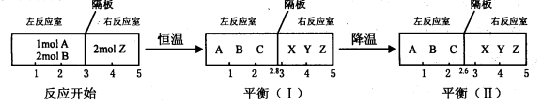
(1)A(g)+2B(g) 2C(g)的△H 0(填“>”、“<”或“=”)。
2C(g)的△H 0(填“>”、“<”或“=”)。
(2)在平衡(I)和平衡(Ⅱ)中,X的体积分数(填序号)。
a.一定相等 b.一定不相等 c.可能相等
(3)达到平衡(I)时,A的转化率为。
铝是地壳中含量最高的金属元素,其单质、合金及其化合物在生产生活中的应用日趋广泛,铝土矿是生产铝及其化合物的重要原料。
(1)铝元素在元素周期表中的位置是____。
(2)铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。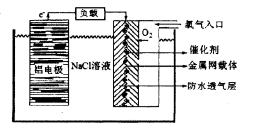
①该电池的总反应化学方程式为____;
②电池中NaCI的作用是。
③以铝一空气电池为电源电解KI溶液制取KIO3(石墨为电极材料)时,电解过程中阳极的电极反应式为。
④某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCI溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为。(3)氯化铝广泛用于有机合成和石油工业的催化剂,聚氯化铝也被用于城市污水处理。
①氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则其结构式为。
②将铝土矿粉与碳粉混合后加热并通入氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式。