已知:H2O(g)===H2O(l) ΔH1=Q1 kJ/mol①
C2H5OH(g)===C2H5OH(l) ΔH2=Q2 kJ/mol②
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH3=Q3 kJ/mol③
若使1mol乙醇液体完全燃烧,最后恢复到室温,则放出的热量为
| A.Q1-3Q2+Q3 | B.3Q1-Q2+Q3 | C.Q1+Q2+Q3 | D.2(Q1+Q2+Q3) |
下列陈述I、II正确并且有因果关系的是:
| 选项 |
陈述I |
陈述II |
| A |
常温下铁与浓硫酸、浓硝酸均不反应 |
可用铁槽车密封运送浓硫酸、浓硝酸 |
| B |
H2O2、SO2都能使酸性KMnO4褪色 |
H2O2表现还原性,SO2表现漂白性 |
| C |
Al有还原性 |
利用铝热反应冶炼金属Mn |
| D |
将水蒸气通过灼热的铁粉,铁粉变红褐色 |
铁粉与水蒸气反应生成Fe2O3 |
下列离子方程式正确的是
| A.Cl2通入水中:Cl2+H2O=2H+ +Cl-+ClO- |
| B.双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O |
C.用铜作电极电解CuSO4溶液:2Cu2++2H2O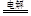 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| D.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe - 3e- = Fe3+ |
用NA表示阿伏加德罗常数的数值,下列说法正确的是
| A.46 g NO2和N2O4的混合物中含有的氮原子数为NA |
| B.常温常压下,22.4L乙烯中含极性共价键数目为5NA |
| C.1 L 0.1 mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2 NA |
| D.1 mol羟基(—OH)中含电子数为10 NA |
下列有关物质的性质、应用等的说法正确的是()
| A.SiO2不能溶于任何酸 |
| B.在同浓度、同体积的碳酸钠和碳酸氢钠溶液中,各加入两滴酚酞,碳酸氢钠溶液中红色较深 |
| C.浓硫酸能干燥SO2等气体,说明浓硫酸具有吸水性 |
| D.自来水厂可用明矾对水进行消毒杀菌 |
在实验室,称取一定量的粗盐经溶解、过滤、结晶等操作,可得到较纯净的食盐。下列图示对应的操作不规范的是