下列有关化学用语表示正确的是
A.比例模型 可以表示二氧化硫分子,也可以表示二氧化碳分子 可以表示二氧化硫分子,也可以表示二氧化碳分子 |
B.电子式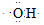 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
C.离子结构示意图 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
| D.结构简式(CH3)2CHOH可以表示1—丙醇,也可以表示2—丙醇 |
室温时,下列混合溶液的PH一定小于7的是
| A.PH=3的盐酸和PH=11的氨水等体积混合 |
| B.PH=3的盐酸和PH=11的氢氧化钡等体积混合 |
| C.PH=3的醋酸和PH=11的氢氧化钡等体积混合 |
| D.PH=3的硫酸和PH=11的氨水等体积混合 |
对A2+3B2 2AB3的反应,以下反应速率的表示中,速率最快的是
2AB3的反应,以下反应速率的表示中,速率最快的是
| A.v(AB3)=0.5mol/(L·min) | B.v(B2)=0.6mol/(L·min) |
| C.v(A2)=0.4mol/(L·min) | D.v(A2)="0.3mol/(L·min)" |
可逆反应:2NO2(g) 2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡
2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡
状态的标志是
①单位时间内生成nmol O2的同时生成2nmol NO2②单位时间内生成nmol O2的同时生成2nmol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
| A.①④ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
对下列实验现象的解释不正确的是
| 选项 |
实验现象 |
解释 |
| A |
C12使鲜艳的红色花瓣褪色 |
Cl2具有强还原性 |
| B |
NH3与HCl气体接触时有白烟产生 |
NH3与HCl反应生成固体小颗粒 |
| C |
新切开的Na表面在空气中很快变暗 |
Na容易与空气中的氧气等反应 |
| D |
氯化铝溶液中滴入过量的氢氧化钠溶液,白色沉淀溶解 |
氢氧化铝具有两性 |
“绿色化学”的主要内容之一是指从技术、经济上设计可行的化学反应,使原子充分利用,
不产生污染物。若以铜为原料制取硫酸铜或硝酸铜,下列设计你认为符合“绿色化学”思想
的反应路线(用化学方程式表示)是
| A.制CuSO4:Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O |
| B.制CuSO4:2Cu + O2= 2CuO; CuO + H2SO4(稀) = CuSO4 + H2O |
| C.制Cu(NO3)2:Cu + 4HNO3(浓) = Cu(NO3)2 +2NO2↑+ 2H2O |
| D.制Cu(NO3)2:3Cu + 8HNO3(稀) = 3Cu(NO3)2 +2NO↑+ 4H2O |