硫酸盐有着广泛的应用。
(1)以下是CuSO4·5H2O的实验室制备流程图。
根据题意完成下列填空:
① 理论上,为了制得纯净的CuSO4·5H2O晶体,需要消耗稀硫酸、稀硝酸溶质物质的量之比为 ,发生反应的离子方程式为 。
② 实际生产过程中对所加稀硝酸的浓度控制要求比较高,通常用标准氢氧化钠溶液来滴定。滴定过程中若用酚酞作指示剂,终点现象是 。请在下图中画出滴定过程中溶液的pH随所滴加氢氧化钠溶液体积的变化的曲线图(要求过A点)。
③用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢 复到电解前的浓度和pH(不考虑CO2的溶解)。则电解过程中共转移电子的物质的量为
(2)为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀。
② 、 、 (依次填写实验操作名称)。
③冷却、称重。
若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为: mol.
(用含m、n的代数式表示)。
(3)PbSO4难溶于水却可溶于醋酸,你认为可能的原因是
①醋酸铅可溶于水 ②醋酸铅是弱电解质
③醋酸铅在水中形成电离平衡时的c(Pb2+)小于PbSO4的溶解平衡的c(Pb2+)
⑤因醋酸是弱酸,故反应可进行
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。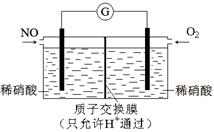
(1)氧化—还原法消除氮氧化物的转化: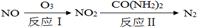
反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) ΔH=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式 。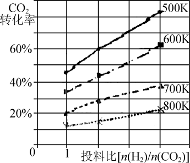
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
该反应平衡常数表达式为K= 。
已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________(填“大于”、“小于”或“等于”)0。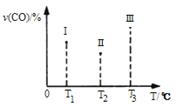
(4)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g)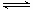 CH3OH(g) ΔH<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) ΔH<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
雾霾严重影响人们的生活,汽车尾气排放是造成雾霾天气的重要原因之一.已知汽车尾气排放时容易发生以下反应:
①N2(g)+O2(g)⇌2NO(g)△H1="a" kJ•mol﹣1
②2NO(g)+O2(g)⇌2NO2(g)△H2="b" kJ•mol﹣1
③CO(g)+1/2O2(g)⇌CO2(g)△H3="c" kJ•mol﹣1
④2CO(g)+2NO(g)⇌N2(g)+2CO2(g)△H4
请回答下列问题:
(1)根据反应①②③,确定反应④中△H4 = kJ•mol﹣1。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应①的Kp= (用表达式表示).
(3)下列情况能说明反应②已达平衡状态的是 (填编号).
A.单位时间内生成1mol NO2的同时消耗了lmol NO
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,NO的体积分数保持不变
(4)探究反应④中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线.试分析实际化工生产中不采用高压的原因 。
(5)探究反应④中平衡时CO2的体积分数与反应物中 的比值、温度的关系,得到如图2所示的曲线。
的比值、温度的关系,得到如图2所示的曲线。
①在X、Y、Z三点中,CO的转化率从大到小的顺序是 。
②若保持其他条件不变,请在图2中,画出温度为T2(T2<T1)时的变化趋势曲线.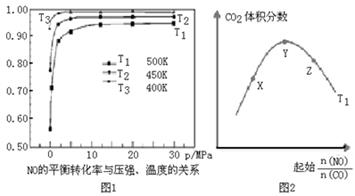
酸牛奶是人们喜爱的一种营养饮料,酸牛奶中有乳酸菌可产生乳酸等有机酸,使酸碱度降低,有效地抑制肠道内病菌的繁殖,酸牛奶中的乳酸可增进食欲,促进胃液分泌,增强肠胃的消化功能,对人体具有长寿和保健作用,乳酸的结构为:CH3CH(OH)COOH
工业上它可由乙烯来合成,方法如下:
CH2=CH2 A
A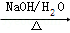 B
B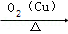 CH3CHO
CH3CHO C
C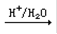 CH3CH(OH)COOH
CH3CH(OH)COOH
(提示:(1)CH3Cl+NaOH CH3OH+NaCl,
CH3OH+NaCl,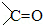 的加成类似于
的加成类似于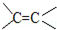 的加成)
的加成)
(1)乳酸所含的官能团的名称是 。
(2)写出下列转化的化学方程式:
①A的生成 。
②C的生成 。
③乳酸在一定条件合成聚乳酸 。
(3)写出符合下列要求的乳酸的所有同分异构体的结构简式 。
a、属于酯类 b、含有﹣OH c、能发生银镜反应.
下表是某食用碘盐包装袋上的部分说明:
| 配料 |
食盐、碘酸钾、抗结剂 |
| 碘含量 |
35±15mg/kg |
| 储藏方法 |
密封、避光、防潮 |
| 食用方法 |
烹饪时,待食品熟后加入碘盐 |
(1)下列说法正确的是
A.高温会导致碘的损失
B.碘酸钾可氧化氯化钠
C.只用淀粉就能检验碘盐中的碘酸钾
D.该碘盐中碘酸钾含量为20~50mg/kg
(2)碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应的方程式为:KI + 3H2O KIO3 + 3H2↑。则阳极电极反应式为
KIO3 + 3H2↑。则阳极电极反应式为
(3)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式,标出电子转移方向和数目。
KIO3+ KI+ H2SO4= K2SO4+ I2+ H2O
该反应的氧化剂为
(4)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用碘盐中碘的含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解 b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全 c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。则所测盐中碘的含量是(以含w的代数式表示) mg/kg。
高铁酸盐(K2FeO4、Na2FeO4)在能源、环保等方面有着广泛的用途。干法、湿法制备高铁酸盐的原理如下表所示。
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色K2FeO4和KNO2等产物 |
| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色Na2FeO4溶液 |
(1)干法制备K2FeO4的化学方程式为Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
2K2FeO4+3KNO2+2H2O,该反应中氧化剂与还原剂的物质的量之比为 。
(2)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
|