市售某种氮肥中,主要成分为尿素[化学式为:CO(NH2)2]若含量在96%以上为达标一级产品。请回答:
⑴尿素的相对分子质量是 ;其中氢和氧元素质量比为 _____________,氮元素的质量分数为_________。(保留一位小数)
⑵经测定该化肥的氮元素质量分数为45%,请计算确定是否达到一级品标准。
⑶某农民向田里使用50千克的这种化肥,如果改用NH4NO3 需要购买多少千克才能有相同量的氮元素(保留一位小数)
苯甲酸(C 7H 6O 2)是最常用的食品防腐剂.苯甲酸中碳、氢、氧元素的质量比为 ,它们的原子个数比是 .
某氯化钡样品23.1g中含有少量的氯化钠,某同学进行了如图所示的实验.请计算:
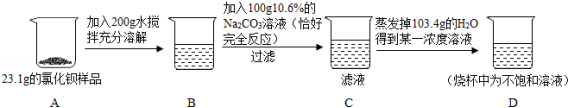
(1)过滤后得到沉淀多少克?
(2)原样品中氯化钡的质量分数?(计算结果精确到0.1%)
(3)求D烧杯中所得溶液的溶质质量分数是多少?
PX是1,4﹣二甲苯(化学式为C8H10)的别称.是一种重要的化工原料,有剧毒、易燃.2015年,某市PX项目发生爆炸并引起大火,PX项目又一次引起人们的热议.请计算:
(1)PX的相对分子质量为 .
(2) 克的Na2CO3与1gPX含碳元素质量相等.
某化学兴趣小组同学欲测定某铁粉与碳粉混合物中铁的质量分数,他们进行了如图所示的实验。请计算;

(1)混合物中铁的质量;
(2)反应后烧杯中稀硫酸无剩余,请计算所用稀硫酸溶液中溶质的质量分数;
(3)欲用98%的浓硫酸配制该浓度的稀硫酸200g,需要水多少克?
实验室有一瓶硫酸溶液,老师请小明同学设计方案测定该溶液的溶质的质量分数。小明先取一只洁净的小烧杯,称其质量为16.4g,然后往其中倒入少量硫酸溶液后称量,总质量为30.2g,之后,将一枚质量为11.8g的铁钉(已用砂纸打磨去年铁锈)放入该小烧杯中,待铁钉表面不再有气泡产生后,再次称量,总质量为41.9g。请回答下列问题:
(1)写出上述反应的化学方程式是 。
(2)反应后产生的气体的质量是 。
(3)计算该硫酸溶液的溶质的质量分数(写出计算过程,计算结果精确到0.1%)。