在2L密闭容器中充入1mol H2和1mol I2蒸气,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)==2HI(g) △H<0达到平衡时候n(H2)为0.8mol
(1) 保持容器容积不变,向其中加入1molH2,反应速率 (填加快、减慢、不变、不确定),理由是 。
(2) 保持容器气体压强不变,向其中加入1molHe,反应速率 (填加快、减慢、不变、不确定),理由是 。平衡 (正向或逆向或不)移动
(3)计算该温度下的平衡常数
(16分)金属钛被称为铁和铝之后崛起的“第三金属”,常见化合价为+4。它是空间技术、航海、化工、医疗上不可缺少的材料。
Ⅰ.工业上用钛铁矿(主要成分FeTiO3)制备金属钛的一种工艺流程如下图(部分产物略去):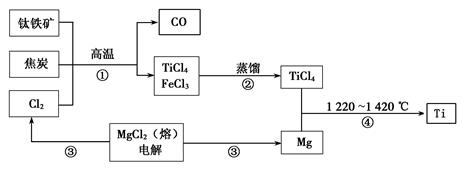
(1)步骤①反应的化学方程式为:2FeTiO3 + 6C + 7Cl2高温2FeCl3 + 2TiCl4 + 6CO,还原剂是。
(2)步骤②分离出TiCl4的方法,利用了TiCl4与FeCl3的不同。
(3)步骤④反应的化学方程式为____________,该反应在氩气中进行的理由是__________。
(4)绿色化学提倡物料循环。以上流程中,可用于循环的物质除Cl2、Mg外,还有__________。
II. 工业上也可用TiO2通过下述两种方法制备金属钛:
方法一:先将TiO2氯化为TiCl4,再还原得到Ti。
(5)氯化反应TiO2 (s) +2Cl2 (g) TiCl4(l) + O2 (g)无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因:。
TiCl4(l) + O2 (g)无法自发正向进行,在反应器中加入碳,则在高温条件下反应可顺利进行。试从化学平衡角度解释,往氯化反应器中加碳的原因:。
方法二:以熔融盐为电解液电解TiO2获得Ti。其中碳块为阳极,电极反应式为:2O2ˉ4eˉ=O2↑;TiO2作阴极,被还原。
(6)阴极的电极反应式为。
(7)电解过程中需定期向电解槽中加入碳块的原因是。
(14分)短周期元素X、Y、Z可组成化学式为XYZ3的化合物甲、乙、丙、丁。
(1)若甲中X的原子只有一个质子,Y、Z均是第二周期元素,则Y元素的原子结构示意图为;Y、Z中非金属性较强的是(填元素符号)。
(2)若乙中X元素的焰色反应为黄色,Y与X同周期,Y是同周期中原子半径最小的元素,则X与Y形成的化合物含键(填“离子”或“共价”);乙与浓盐酸反应生成Y单质的化学方程式为。
(3)若丙是一种微溶于水的物质,其Ksp约为1×10-10,且X、Y、Z三种元素的原子序数之和为26,Y、Z同周期,则丙的电离方程式为,其饱和溶液中X离子的浓度约为mol·L-1。
(4)若丁中X、Y、Z处于不同周期,且X原子最外层电子数为其次外层电子数的二倍,Z原子最外层电子数是其电子层数的二倍多1,则丁的结构式为。
ClO2气体是一种常用的消毒剂,我国从2000年起已逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将Fe2+、Mn2+转化成Fe(OH)3、MnO2难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有性。
(2)工业上可以通过下列方法制取ClO2,请完成该反应化学方程式:2KClO3+SO2=2ClO2+___。
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1—0.8mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
I.取一定体积的水样用氢氧化钠溶液调至中性,然后加入一定量的碘化钾,并加入淀粉溶液,溶液变蓝。
II.加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2═S4O62-+2I-)
III.加硫酸调节水样pH至1.3。操作时,不同pH环境中粒子种类如下图所示:
请回答:
①操作I中反应的离子方程式是。
②确定操作II完全反应的现象是。
③在操作III过程中,溶液又呈蓝色,反应的离子方程式是。
④若水样的体积为1.0L,在操作II时消耗了1.0×10-3mol/L的Na2S2O3溶液10mL,则水样中ClO2的浓度是mg/L。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是。
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为(用元素符号作答)
(5)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为。
(6)由Q和Y两种元素形成的晶体的熔点比金刚石的熔点(填“高”或“低”)。原因是。
(8分)(1)前三周期元素中第一电离能最小的是(填元素符号),其基态原子的电子排布式为。第二周期非金属元素形成的氢化物中化学键极性最大的是(填分子式),该物质在CCl4中的溶解度比在水中的溶解度(填“大”或“小”)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是(填物质字母代号)。
| 代号 |
物质 |
结构简式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
| A |
邻-硝基苯酚 |
 |
0.2 |
45 |
100 |
| B |
对-硝基苯酚 |
 |
1.7 |
114 |
295 |
(3)晶格能的大小:MgONaCl,键能的大小:HBrHI。(填“>”、“=”或“<”)
(4)下列物质的熔点高低顺序,正确的是
A.晶体硅>二氧化硅>碳化硅
B.CI4 >CBr4>CCl4>CH4
C.SiF4>NaF>NaCl>NaBr