反应4NH3(g) + 5O2(g) =" 4NO(g)" + 6H2O(g)在10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率v(X)可表示为( )
| A.v(NH3)=0.01mol/L/s |
| B.v(O2)=0.001mol/L/s |
| C.v(NO)="0.001" mol/L/s |
| D.v(H2O)="0.045" mol/L/s |
在某2L恒容密团容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g) 3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是
3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示:下列推断正确的是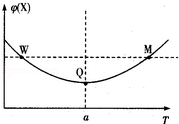
| A.升高温度,平衡常数增大 |
| B.W点Y的正反应速率等于M点Y的正反应速率 |
| C.Q点时,Y的转化率最大 |
| D.平衡时充入Z.达到新平衡时Z的体积分数比原平衡时大 |
3molA和2.5molB混合于容积为2L的容器内,使它们发生反应2A(s)+3B(g) 2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
2C(g)+D(g),经过5min生成0.5molD,下列说法正确的是
| A.B的平均消耗速率为0.3mol/(L•min) |
| B.C的平衡浓度为2mol/L |
| C.平衡后,增大压强,平衡将向正方向移动 |
| D.若反应容器内气体的密度不再发生变化,说明反应已经达到平衡 |
下列离子方程式正确的是
| A.钠与水反应:Na+2H2O=Na++2OH﹣+H2↑ |
| B.稀硝酸中加入过量铁粉:Fe+4H++NO3﹣=Fe3++NO↑+2H2O |
| C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++A13++2SO42﹣+2Ba2++4OH-=2BaSO4↓+A1(OH)3↓+NH3•H2O |
| D.向次氯酸钙溶液通入SO2:Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
下列有关溶液组成的描述合理的是
| A.由水电离出的c(H+)=10﹣13mol•L﹣1的溶液中可能存在:HCO3﹣、K+、Na+、Cl﹣ |
| B.酸性溶液中可能大量存在Na+、ClO﹣、SO42﹣、I﹣ |
| C.含有0.1 mol•L﹣1 Fe3+的溶液中可以大量存在:K+、Mg2+、I﹣、NO3﹣ |
| D.室温下,pH=l的溶液中一定可以存在:Na+、Fe3+、NO3﹣、SO42﹣ |
下列陈述I、II均正确且有因果关系的是
| 陈述I |
陈述II |
|
| 1 |
常温下铁与浓硫酸不反应 |
可用铁槽车密封运送浓硫酸 |
| 2 |
NaHCO3溶于水完全电离 |
NaHCO3是强电解质 |
| 3 |
NH4Cl为强酸弱碱盐 |
用加热法除去NaCl中的NH4Cl |
| 4 |
H2O2、SO2能使酸性KMnO4溶液褪色 |
H2O2表现还原性,SO2表现漂白性 |
A.1 B.2C.3 D.4