有Fe2+、NO 、Fe3+、NH
、Fe3+、NH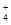 、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
、H+和H2O六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述错误的是( )
A.还原产物为NH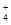 |
| B.氧化剂与还原剂的物质的量之比为8∶1 |
C.若有1 mol NO 作氧化剂,则转移8 mol e- 作氧化剂,则转移8 mol e- |
| D.若把该反应设计为原电池,则负极反应为Fe2+-e-===Fe3+ |
下列对各组离子或物质是否能够大量共存解释正确的是( )
| A |
常温常压下NH3、O2、H2、CO2 |
不能共存 |
NH3为碱性气体、CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B |
c(OH-)=1.0×10-13 mol/L溶液中,Fe2+、NO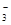 、SO 、SO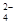 、Na+ 、Na+ |
不能共存 |
发生反应:3Fe2++NO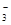 +4H+===3Fe3++NO↑+2H2O +4H+===3Fe3++NO↑+2H2O |
| C |
溶液中:K+、Cu2+、Cl-、NH3·H2O |
不能共存 |
发生反应:Cu2++2OH-===Cu(OH)2↓ |
| D |
溶液中:Al3+、Na+、SO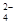 、HCO 、HCO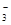 |
可以共存 |
不能发生反应 |
下列实验现象所对应的离子方程式不正确的是( )
| 实验 |
现象 |
离子方程式 |
|
| A |
  |
在空气中放置一段时间溶液呈蓝色 |
4H++4I-+O2===2I2+2H2O |
| B |
  |
开始时无气泡,后来有气泡 |
CO +H+===HCO +H+===HCO HCO  +H+===H2O+CO2↑ +H+===H2O+CO2↑ |
| C |
  |
溶液由黄绿色变为无色 |
Cl2+2OH-===Cl-+ClO-+H2O |
| D |
  |
有白色沉淀生成,溶液由红色变为无色 |
Ba2++OH-+H++SO ===BaSO4↓+H2O ===BaSO4↓+H2O |
某合作学习小组讨论辨析以下8种说法,其中正确的是( )
①粗盐和酸雨都是混合物 ②沼气和水煤气都是可再生能源 ③冰和干冰既是纯净物又是化合物 ④不锈钢和目前流通的硬币都是合金 ⑤盐酸和食醋均既是化合物又是酸 ⑥纯碱和熟石灰都是碱 ⑦雾、烟都是胶体 ⑧利用丁达尔效应可以区分溶液和胶体
| A.①②③④⑥ | B.①③④⑦⑧ |
| C.③④⑤⑥⑦ | D.①②④⑤⑧ |
某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480 mL含NaClO 25%,密度为1.19 g/cm3的消毒液。下列说法正确的是( )
| A.配制过程只需要三种仪器即可完成 |
| B.容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制 |
| C.所配得的NaClO消毒液在空气中光照,久置后溶液中NaClO的物质的量浓度减小 |
| D.需要称量的NaClO固体的质量为140 g |