金属是人类生产、生活中不可缺少的重要材料
(1)生铁是 (填化学式)和铁的合金,生铁的硬度比纯铁 (填高、低)。
(2)生铁放置在潮湿的空气发生电化学腐蚀时的正极反应为 ;负极反应为 ;用盐酸可以除去生铁表面的铁锈,该反应的离子方程式为 。
(3)下列对金属制品采取的防护方法不正确的是 (填序号)。
①在电线的外面包上一层塑料层
②在自行车钢圈上镀上一层金属铬
③在海轮的铁制外壳上焊上铜块
④在铁制的暖气片上刷一层油漆
香草醛结构简式为: ,请按要求完成下列问题:
,请按要求完成下列问题:
(1)香草醛有多种同分异构体,其中苯环上的一溴代物只有两种且属于芳香酸的结构简式___________;
(2)香草醛的同分异构体中属于芳香酯有种。其中某些酯与NaOH作用只能消耗等物质的量的NaOH,写出符合该条件的一种酯在NaOH溶液中水解的化学方程式:。
(3)写出香草醛发生银镜反应的化学方程式:______________________________。
(3分)肉桂醛的结构为: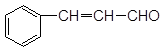
①把足量肉桂醛加入到溴水中,溴水褪色了,这____________(填“能”或“不能”)说明肉桂醛中存在碳碳双键。
②检验分子中碳碳双键的方法是_______________。
(3分)在硫酸铜溶液中加入过量的氢氧化钠溶液后,再滴入足量乙醛溶液,加热。实验过程中发生的反应的化学方程式为。
(l)常温下,如果取0.1mol•L﹣1HA溶液与0.1mol•L﹣1NaOH溶液等体积混合,测得混合液的pH=8.混合液中由水电离出的OH﹣浓度与0.1mol•L﹣1NaOH溶液中由水电离出的OH﹣浓度之比为_________ .
(2)相同温度下,将足量硫酸钡固体分别放入相同体积的①0.1mol•L﹣1硫酸铝溶液 ②0.1mol•L﹣1氯化钡溶液 ③蒸馏水 ④0.1mol•L﹣1硫酸溶液中,Ba2+浓度由大到小的顺序是_________ .(用序号填写)
(3)常温下,将a mol•L﹣1的氨水与0.1mol•L﹣1的盐酸等体积混合,当溶液中c(NH4+)=c(Cl﹣)时,用含a的代数式表示NH3•H2O的电离常数Kb= _________ mol•L﹣1.
在标准状况下,取甲、乙、丙各30.0mL 相同浓度的盐酸,然后分别慢慢加入组成相同的镁铝合金粉末,得下表中有关数据(假设反应前后溶液体积不发生变化):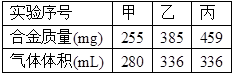
请回答:
(1)甲组实验中,盐酸(选填“过量”、“适量”或“不足量”,下同)__________________;乙组实验中盐酸______________。
(2)盐酸的物质的量浓度为_____________。
(3)合金中Mg. Al 的物质的量之比为_______________。