试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按下图进行实验:
(1)请写出步聚③中发生的全部反应的离子方程式:____________________________________。
(2)要使试样X转变为粉末Z。除了CO外,还可以使用 。
| A.氢气 | B.焦炭 | C.氯气 | D.氧气 |
(3)若全部的溶液Y和全部的粉未Z充分反应,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为(用m表示): 。
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
则N2(g)+3H2(g)=2NH3(g)的△H=。
(2)工业合成氨的反应为N2(g)+3H2(g)  2NH3(g)。在一定温度下,将一定量的N2和H2通入固定体积为1L的密闭容器中达到平衡后,改变下列条件,能使平衡向正反应方向移动的是。
2NH3(g)。在一定温度下,将一定量的N2和H2通入固定体积为1L的密闭容器中达到平衡后,改变下列条件,能使平衡向正反应方向移动的是。
①增大压强②通入He
③使用催化剂④降低温度
(3)工业合成氨的反应为N2(g)+3H2(g)  2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 。计算该条件下达到平衡时N2转化率为;
。计算该条件下达到平衡时N2转化率为;
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:(其中c、d均为碳棒,NaCl溶液的体积为500ml)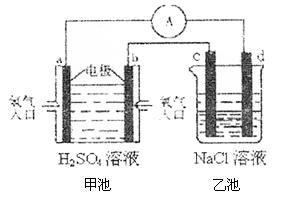
①b极为极,电极反应式;
c极为极,电极反应式
②右图装置中,当b极上消耗的O2在标准状况下的体积为280ml时,则乙池溶液的PH为(假设反应前后溶液体积不变,且NaCl溶液足量)
中学化学几种常见物质的转化关系如下(有些生成物已略去), 其中A是常见的金属单质,F物质是工业上制取烧碱的原料,G、H是常见的非金属单质,其余为化合物,请回答下列问题:
(1)写出指定物质的化学式:A、C、H;
(2)写出下列反应的离子方程式:
①D+I→E+F,
②C与等物质的量的Na2O2在溶液中反应:;
(3)由D的饱和溶液可以制得E胶体,该胶体中E粒子直径的大小范围是,若要提纯E胶体,采用的操作方法叫。
(4)D的水溶液呈性(填酸性、碱性或中性),为抑制这一变化,通常在配制D溶液时, 采取的方法是。
采取的方法是。
菠萝酯是一种食用香料,是化合物甲与苯氧乙酸 发生酯化反应的产物。
发生酯化反应的产物。
(1)甲一定含有的官能团的名称是。
(2)5.8 g甲完全燃烧产生0.3 mol CO2和0.3 mol H2O,甲蒸气对氢气的相对密度是29,甲分子中不含甲基,且为链状结构,其结构简式是。
(3)苯氧乙酸有多种酯类的同分异构体,写出其中能与FeCl3溶液发生显色反应,且苯环上只有两种一硝基取代物的所有可能的同分异构体的结构简式:
。
(4)已知:

菠萝酯的合成路线如下:
①试剂X不能选用的是(选填字母)。
a.CH3COONa溶液 b.NaOH溶液
c.NaHCO3溶液 d.Na
②丙的结构简式是,反应Ⅱ的反应类型是。
③反应Ⅳ的化学方程式是。
下列是A、B、C、D、E、F、G、H及丙二酸(HOOCCH2COOH)间转化反应的关系图。A是一种链状羧酸,分子式为C3H4O2;F中含有由七个原 子构成的环;H是一种高分子化合物。请填写下列空白:
子构成的环;H是一种高分子化合物。请填写下列空白:





















(1)C的结构简式:;F的结构简式:。
(2)写出下列反应的化学方程式和反应类型:
① A→H的化学方程式:,
反应类型_______________。 ② B与NaOH溶液反应的化学方程式:
② B与NaOH溶液反应的化学方程式:
 ,
, 反应类型。
反应类型。 ③ G→丙二酸铵化学方程式:]
③ G→丙二酸铵化学方程式:] _____________________________________,
_____________________________________, 反应类型:。
反应类型:。
选择恰当的试剂和方法除去下列物质中的少量杂质(括号内为杂质)
(1)C2H6(C2H4)试剂__________,方法________________________________________。
(2)溴苯(溴)试剂__________,方法___________________________________________。
(3)苯(甲苯)试剂________ ,方法____________________________________________。
,方法____________________________________________。
(4)溴化钠(溴)试剂__________,方法_______________________________________。