硫酸盐主要来自地层矿物质,多以硫酸钙、硫酸镁的形态存在。
(1)已知:①Na2SO4(s)=Na2S(s)+2O2(g) ; ΔH1=" +1011.0" kJ · mol-1
②C(s)+O2(g)=CO2(g) ; ΔH2=-393.5 kJ · mol-1
③2C(s)+O2(g)="2CO(g)" ;ΔH3=-221.0 kJ · mol-1
则反应④Na2SO4(s)+4C(s)=Na2S(s)+4CO(g);ΔH4= kJ · mol-1,该反应能自发进行的原因是 ;工业上制备Na2S不用反应①,而用反应④的理由是 。
(2)已知不同温度下2SO2+O2 2SO3的平衡常数见下表。
2SO3的平衡常数见下表。
| 温度(℃) |
527 |
758 |
927 |
| 平衡常数 |
784 |
1.0 |
0.04 |
1233℃时,CaSO4热解所得气体的主要成分是SO2和O2,而不是SO3的原因是 。
(3)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
②将上述反应获得的SO2通入含PtCl42-的酸性溶液,可还原出Pt,则反应的离子方程式是 。
③由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图,则正极的电极反应式为 。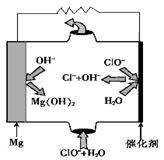
A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1、4、5、7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸,则:
(1)A、B、C、D分别是_________、________、__________、___________。
(2)A的离子结构示意图是____________,C的原子结构示意图是_________________。
(3)C的最高价氧化物对应的水化物与A的氢氧化物生成_______种盐,化学式为_______________。
(4)C、D的气态氢化物稳定性由强到弱的顺序是___________。
(1)工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1 mol CO2和3 mol H2,在500℃下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
CH3OH(g)+H2O(g)实验测得CO2(g)和CH3OH(g)的浓度随时间变化如下图1所示。
①图2是改变温度时H2的化学反应速率随时间变化的示意图,则该反应的正反应是_______(填“吸热”或“放热”)反应;
②从反应开始到第三分钟,氢气的平均反应速率v(H2)=mol·L-1·min-1;
③平衡时CH3OH的体积分数为。
(2)下图中P是可自由平行滑动的活塞,关闭K,在相同温度时,向A容器中充入1.2molCH3OH(g)和2.4molH2O(g),向B容器中充入1.5molCH3OH(g) 和3.0molH2O(g),两容器分别发生上述(1)中反应的逆反应。已知起始时容器A和B的体积均为aL,反应达到平衡时容器B的体积为1.4aL,容器B中CH3OH转化率为;维持其他条件不变,若打开K一段时间后重新达到平衡,容器B的体积为L。(连通管中气体体积忽略不计,且不考虑温度的影响)
(3)一定条件下的密闭容器中,反应3H2(g) + 3CO(g)  CH3OCH3(g) + CO2(g)ΔH<0 达到平衡时,要提高CO的转化率,可以采取的措施是(填字母代号)
CH3OCH3(g) + CO2(g)ΔH<0 达到平衡时,要提高CO的转化率,可以采取的措施是(填字母代号)
A.升温
B.加压
C.增加CO的浓度
D.分离出二甲醚(CH3OCH3)
E.加入催化剂
(4)已知反应2CH3OH(g) CH3OCH3(g)+ H2O(g)在某温度下的平衡常数K=100。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下。下列说法正确的是____________________
CH3OCH3(g)+ H2O(g)在某温度下的平衡常数K=100。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下。下列说法正确的是____________________
| 物质 |
CH3OH |
CH3OCH3 |
H2O |
| c/mol L -1 |
0.9 |
0.60 |
0.60 |
A.CH3OH的起始浓度为2.1 mol/L B.平衡时CH3OH的浓度为0.9 mol/L
C.此时正反应速率大于逆反应速率 D.平衡时CH3OH的转化率小于80%
根据下列化合物:①H2SO4,②CH3COOH,③NaCl,④NaOH,⑤NH4Cl,⑥NH3•H2O,⑦CH3COONH4,⑧CH3COONa,⑨NH4HSO4, 请回答下列问题:
(1)常温下,pH=10的CH3COONa 溶液中,水电离出来的c(H+)=;
(2)已知水存在如下平衡: ,现欲使平衡向右移动,
,现欲使平衡向右移动,
且所得溶液显酸性,选择的下列方法是。
| A.向水中加入NaHSO4固体 | B.向水中加NH4Cl固体 |
| C.加热至100℃ | D.向水中加入NaHCO3固体 |
(3)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液,按pH由大到小的顺序为(填序号)。
(4)物质的量浓度相同的⑤、⑥、⑦、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号)。
(5)若浓度均为0.1 mol·L-1、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n(填 “<”、“>”或“=”)。
(6)向NaCl和KBr的混合溶液中加入AgNO3溶液,当两种沉淀共存时,c(Br-)/c(Cl-)=_____________________。
(已知Ksp(AgCl) =2.0×10-10,Ksp(AgBr) =5.4×10-13)
某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表中②的实验目的:
| 编号 |
实验目的 |
碳粉/g |
铁粉/g |
醋酸/% |
| ① |
为以下实验作参照 |
0.5 |
2.0 |
90.0 |
| ② |
0.5 |
2.0 |
36.0 |
|
| ③ |
碳粉质量的影响 |
0.2 |
2.0 |
90.0 |
(2)编号①实验测得容器中压强随时间变化如图2。t2时,容器中压强明显小于起始压强,其原因是铁发生了吸氧腐蚀;此时,碳粉表面发生了(填“氧化”或“还原”)反应,其电极反应式是:。
(3)该小组对图中0~t1时压强变大的原因提出如下假设。
请你完成假设二:
假设一:发生析氢腐蚀产生了气体;
假设二:;
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。请你再设计一个实验方案验证假设一,写出实验步骤及结论:。
(8分)按要求填空。
(1)根据常温下氯化铵、氢氧化钡两种晶体混合搅拌反应的现象判断:
该反应△S0,△H0 [均填“<”、“>”或“=”, (2)同]
(2)已知:升高温度时,反应2CH4(g)  C2H4(g)+2H2(g)的平衡转化率增大,现有:
C2H4(g)+2H2(g)的平衡转化率增大,现有:
2C(s)+2H2(g)  C2H4(g) ΔH1 ;C(s)+2H2(g)
C2H4(g) ΔH1 ;C(s)+2H2(g)  CH4(g) ΔH2则ΔH12ΔH2
CH4(g) ΔH2则ΔH12ΔH2
(3)在常温常压下测得:C(s)的燃烧热为393 kJ/mol,而1molC(s)燃烧成CO(g)放热110kJ,则CO的燃烧热为
(4)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式: