已知A、B、C、D为常见单质,其中B、C、D常温常压下为气体,甲、乙、丙、丁为化合物,乙常温下为液体,丙的焰色反应为黄色,下图为各种物质之间的相互反应
(1)写出下列物质的化学式:
A ,B ,D ,丙 。
(2)丙电子式为 ,反应②中若有11.2L(标准状况下)B生成,则发生转移的电
子的物质的量为 。
(3)写出反应③的化学方程式:
芳香烃X是一种重要的有机化工原料,其摩尔质量为92g·mol一1,某课题小组以它为原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。已知A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。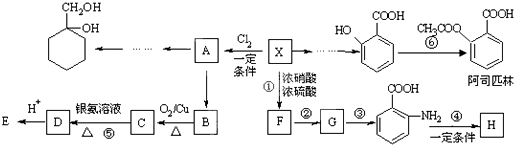
已知:
回答下列问题:
(1)对于阿司匹林,下列说法正确的是_______
| A.是乙酸的同系物 |
| B.能发生酯化反应 |
| C.1 mol阿司匹林最多能消耗2mol NaOH |
| D.不能发生加成反应 |
(2)H的结构简式是_________,F→G的反应类型是_______。
(3)写出C→D的化学方程式_______。
( 4)写出符合下列条件的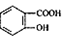 的同分异构体的结构简式_______。(写出2种)
的同分异构体的结构简式_______。(写出2种)
①属于芳香族化合物,且能发生银镜反应;
②核磁共振氢谱图中峰面积之比为1 :2:2:1
③分子中有2个羟基
(5)以A为原料可合成 ,请设计合成路线,要求不超过4步(无机试剂任选)。
,请设计合成路线,要求不超过4步(无机试剂任选)。
注:合成路线的书写格式参照如下示例流程图:
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾履形成的原因。
(1)汽车尾气净化的主要原理为;2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____。
| A.在单位时问内生成1mol CO2的同时消耗了lmol CO |
| B.混合气体的密度不再改变 |
| C.混合气体的平均相对分子质量不再改变 |
| D.混合气体的压强不再变化 |
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2到t4时刻正反应速率随时间的变化曲线: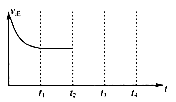
③若要同时提高该反应的速率和NO的转化率,采取的措施有_____、____。(写出2个)
(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,其反应原理为C(s)+H2O(g) CO(g)+H2(g) △H=+131.3kJ/mol。
CO(g)+H2(g) △H=+131.3kJ/mol。
①该反应在___下能自发进行(填“高温”或“低温”)。
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为____。(已知:H2S:Ka1=9.1×10-8;Ka2=1.1×10-12。H2CO3:Ka1=4.30×10-7;Ka2=5.61×10-11)
(3)已知反应:CO(g)+H2O(g) CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通人到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
| 实验 |
温度/℃ |
起始量/mol |
平衡量/mol |
达平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
| 3 |
900 |
a |
b |
c |
d |
t |
①实验1条件下平衡常数K=______(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是______。
③该反应的△H ______0(填“<”或“>”);若在9000C时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时υ正______υ逆(填“<”,“>”,“=”)。
可降解聚合物聚碳酸酯的合成路线如下,其制备过程中还可制得高分子材料F。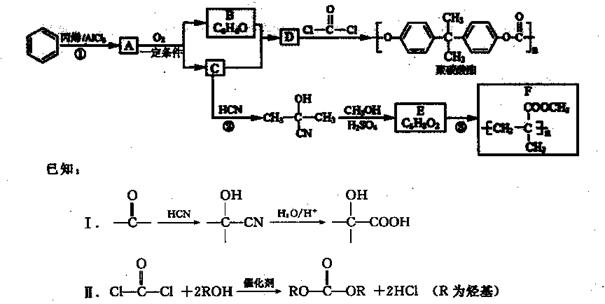
回答下列问题:
(1)反应①的反应类型为。
(2)写出D的结构简武 。
(3)E(C5H8O2)分子中所含官能团的名称 。
(4)写出在一定条件下D与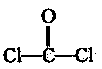 反应合成聚碳酯的化学方程式 。
反应合成聚碳酯的化学方程式 。
(5)写出一种同时符合下列条件的E的同分异构体的结构简式。
①与E具有相同官能团
②能发生银镜反应
③H核磁共振谱中有四种不同环境的氢原子,比例分别为1:2:2:3
(6)依据绿色化学原理,原子的利用率为100%。以丙炔、甲醇为原料可合成F,请设计合成路线(无机试剂任选)。合成路线流程图示例如下: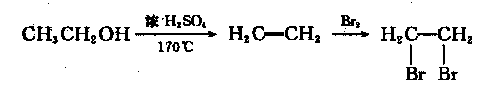
2013年雾霾天气多次肆虐我国中东部地区。其中汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO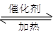 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作KP),则该反应的KP=-。
②该反应在低温下能自发进行,该反应的ΔH 0。(选填“>”、“<”)
③在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如图所示(已知:t2 --tl=t3-t2)。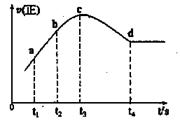
则下列说法不正确的是。(填编号)
A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:tl~t2>t2~t3
(2)煤的综合利用、使用清洁能源等有利于减少环境污染。合成氨工业原料气的来源之一水煤气法,在催化剂存在条件下有下列反应:
①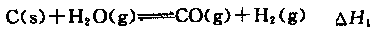
②
③
①△H3和△H1、△H2的关系为△H3=。
②在恒温条件下,将l mol CO和1 mol H2O(g)充入某固定容积的反应容器,达到平衡时有50%的CO转化为CO2。在tl时保持温度不变,再充入1 mol H2O(g),请在图中画出tl时刻后H2的体积分数变化趋势曲线。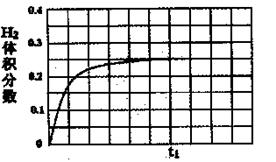
③甲醇汽油可’以减少汽车尾气对环境的污染。
某化工厂用水煤气为原料合成甲醇,恒温条件下,在体积可变的密闭容器中发生反应:CO(g)+2H2(g)  CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正)v(逆)(选填‘‘>”、“<’’或“=”),判断的理由。
CH3OH(g)到达平衡时,测得CO、H2、CH3OH分别为1 mol、1 mol、1 mol,容器的体积为3L,现往容器中继续通人3 mol CO,此时v(正)v(逆)(选填‘‘>”、“<’’或“=”),判断的理由。
某化合物M(式量为80)俗称黑肥宝,它由原子序数不大于20的X、Y、Z三种元素组成,X、Y、Z的原子序数依次增大,其关系为Z=X+2Y。X、Y是同周期相邻的两种元素。M微溶于水,在常温下与水作用发生缓慢水解,最终产物为一种白色沉淀A与气体B,该气体能使湿润的红色石蕊试纸变蓝,A在高温条件下可分解产生一种有温室效应的气体。(注:以下回答若涉及到具体物质均用相应的化学式或元素符号表示)
(1)化合物M的化学式为;Z的原子结构示意图为。
(2)写出下列反应的化学方程式。A在高温下分解:; M与水反应生成A和B:。
(3)Z的氢化物可作为一种储氢材料,写出其与水反应的化学方程式 。
(4)储氢材料的研究很广泛。下列物质中,可作为储氢材料的是。(填编号)
| A.Ca(OH)2 | B.MgH2 | C.O2 | D.LaNi5 |
(5)物质B有如下转化关系: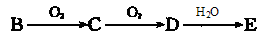 (强酸),将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐,请设计一个实验方案检验其中的阴离子。
(强酸),将C和D的混气体通入NaOH溶液中恰好完全反应得到一种盐,请设计一个实验方案检验其中的阴离子。