已知二氧化硫可使酸性高锰酸钾溶液褪色,化学反应方程式为:





 5SO2 + 2KMnO4 + 2H2O ="==" K2SO4 + 2MnSO4 + 2H2SO4用下图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2
5SO2 + 2KMnO4 + 2H2O ="==" K2SO4 + 2MnSO4 + 2H2SO4用下图装置来验证浓硫酸与木炭在加热条件下反应的产物中含有SO2和CO2
(1)实验时,反应产生的气体应从 端通入;从 端连接盛有澄清石灰水的实验装置(用“a”或“b”填空)。
(2)A瓶的实验现象是 。
(3)C瓶溶液的作用是 。
下图是维生素A的分子结构: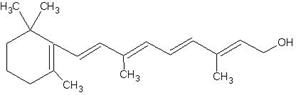
(1)维生素A中的含氧官能团是(写名称);
(2)维生素A的分子式是;
有A、B、C三种烃的衍生物,相互转化关系如下:
其中B可发生银镜反应,C跟石灰石反应产生能使石灰水变浑浊的气体,则:
(1)推断A、B、C的名称依次是:_________、____________、______________-。
(2)写出下列反应的化学方程式
A→B _________________________________
B→C ________________________ __________
B→A __________________________________
B的银镜反应___________________________________
(8分)下列有机物中,有多个官能团: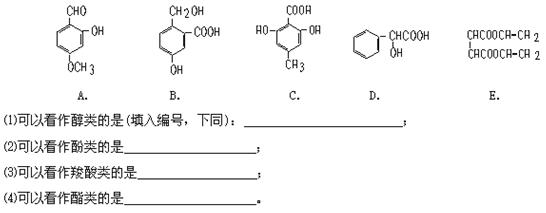
有机物A 0.02 mol 在氧气中完全燃烧生成4.4g CO2和2.16g H2O,无其它物质生成。试回答下列问题:
⑴下列说法中正确的是(填写序号)
| A.该化合物肯定含O元素 | B.该化合物可能不含O元素 |
| C.该化合物肯定不能和Na反应 | D.该分子中C:H的个数比为5:12 |
⑵若A为烃,且它的一卤代物只有一种结构,此烃的结构简式为:。用系统法命名为:。此烃共有种同分异构体。
⑶若A为一元醇且在空气中不能被Cu催化氧化成相应的醛。则A的结构简式为,其名称(系统命名)为
1mol醇A与足量钠反应,可生成H2的体积为L(STP).
为了减少温室气体排放,目前工业上采用CO2与H2在CuO-ZnO/ZrO催化下反应制备重要化工原料CH3OH的工艺:CO2(g)+3H2(g)  CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
CH3OH(g)+H2O(g);⊿H<0。为了探究其反应原理进行如下实验,在2L密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(CO2)(mol) |
0.40 |
0.35 |
0.31 |
0.3 |
0.3 |
0.3 |
根据题目回答下列问题:
(1)0~3 s内用H2表示的平均反应速率是,
(2)平衡时CO2的转化率是。
(3)能说明反应已达平衡状态的是。
A.υ(H2)=3υ(CO2) B.容器内压强保持不变
C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是。(填序号)
A.及时分离出产物 B.适当升高温度
C.增大CO2浓度 D.选择适当的催化剂