(4分) 将一定量的Fe粉、Cu粉、FeCl3溶液、CuCl2溶液混合于某容器中充分反应(假定容器不参与反应),试判断下列情况下容器中金属离子与金属单质的存在情况:
(1)若Fe粉有剩余,则容器中不可能有____________
(2)若FeCl3有剩余,则容器中不可能有___________
(3)若CuCl2有剩余,则容器中还可能有________________________
(4)若FeCl3和CuCl2都有剩余,则容器中还可能有______________
(6分)根据下表信息回答以下问题:
| 元素 |
A |
B |
C |
D |
E |
F |
G |
H |
| 原子半径(nm) |
0.130 |
0.118 |
0.090 |
0.102 |
0.073 |
0.154 |
0.037 |
0.099 |
| 主要化合价 |
+2 |
+3 |
+2 |
+6,-2 |
-2 |
+1 |
+1 |
+7,-1 |
部分短周期元素的原子半径及主要化合价
(1)将A、D、E、F、H对应的简单离子按照半径由小到大的顺序填空________________。
(2)B、H两元素的最高价氧化物所对应的水化物相互反应的离子方程式是____________________。
(3)实验室中制取H单质反应的化学方程式是______________________________。
已知可逆反应CO(g)+H2O(g) 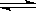 CO2(g)+H2(g),达到平衡时,K=
CO2(g)+H2(g),达到平衡时,K=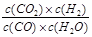 ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时c(CO)="2" mol·L-1,c(H2O)="3" mol·L-1,平衡时CO的转化率为60%,水蒸气的转化率为;K值为。
(2)830 K时,若只将起始时c(H2O)改为6 mol·L-1,则水蒸气的转化率为。
(3)若830 K时,起始浓度c(CO)="a" mol·L-1,c(H2O)="b" mol·L-1,H2的平衡浓度c(H2)="c" mol·L-1①a、b、c之间的关系式是;②当a=b时,a=c。
按下图装置进行实验,并回答下列问题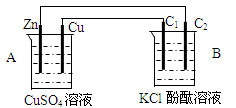
(1)判断装置的名称:A池为B池为
(2)铜极为______极,电极反应式为
(3)B装置中,C1与C2均为石墨棒,石墨棒C1为___极,电极反应式为,石墨棒C2附近发生的实验现象为
(4)当C2极析出224mL(标准状态)气体时,锌的质量减少g.
把一根卷成螺旋状的铜丝在酒精灯火焰上加热,红色的铜丝变成色,把它立即插入盛有乙醇的试管中,铜丝表面出现的变化是;重复几次同样的操作,试管内液体散发出具有刺激性气味的气体,这是乙醇被而生成之故。在反应后的试管中加入适量的新制氢氧化铜悬浊液,再加热至沸,可发现试管中的混和物中有生成。(以上每空1分)发生该反应的化学方程式。
某烃A 0.2mol在氧气中充分燃烧后,生成化合物B、C各1.2mol。试回答:
(1)烃A的分子式为。
(2)若取一定量的烃A完全燃烧后,生成B、C各3mol,则有g烃A参加了反应,燃烧时消耗标准状况下的氧气L。
(3)若烃A不能使溴水褪色,但在一定条件下,能与氯气发生取代反应,其一氯代物只有一种,则此烃A的结构简式为。
(4)若烃A能使溴水褪色,在催化剂作用下,与氢气加成,其加成产物经测定分子中含有4个甲基。烃A可能有的结构简式为。