已知甲和乙的某些性质如下表:
| 物质 |
熔点(℃) |
沸点(℃) |
密度(g/mL) |
水中的溶解性 |
| 甲 |
-98 |
37.5 |
0.93 |
可溶 |
| 乙 |
-48 |
95.0 |
0.90 |
可溶 |
现有甲和乙的混合物,进行分离时,适宜的方法是
A.蒸发 B.萃取 C.蒸馏 D.过滤
某无色混合气体,依次通过浓硫酸和过氧化钠,气体体积不断减小,颜色变深,则该混合气体的组成是()
| A.H2O(g)和NO、N2 |
| B.NO2、CO2、H2O(g) |
| C.O2、HCl、CO |
| D.NH3、NO、CO2 |
Cu粉放入稀H2SO4中,加热后无现象,当加入一种盐后,Cu粉质量减少,溶液变蓝,同时有气体产生,此盐应是()
| A.KCl | B.K2SO4 |
| C.KNO3 | D.K2CO3 |
相同质量的四份铜片,分别置于足量的下列酸中,所得到的气体的物质的量最多的是()
| A.浓H2SO4 | B.稀H2SO4 |
| C.浓HNO3 | D.稀HNO3 |
锌与不同浓度的硝酸反应,HNO3可以被还原成不同价态的产物。下列化学反应中参加反应的锌与被还原的HNO3的物质的量的关系符合图1-12(x表示被还原的HNO3的物质的量,y表示耗去Zn的物质的量)的是()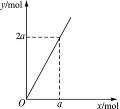
图1-12
| A.3Zn+8HNO3(稀)====3Zn(NO3)2+2NO↑+4H2O |
| B.4Zn+10HNO3(极稀) ====4Zn(NO3)2+NH4NO3+3H2O |
| C.4Zn+10HNO3(很稀) ====4Zn(NO3)2+N2O↑+5H2O |
| D.Zn+4HNO3(浓) ====Zn(NO3)2+NO2↑+2H2O |
将Cu、Zn混合物投入稀HNO3中,充分反应后,锌有剩余,则反应后的溶液中肯定不存在的是()
①Cu ②Cu(NO3)2 ③HNO3④Zn(NO3)2
| A.①和② | B.②和③ |
| C.①和③ | D.②和④ |