m g 铁粉与含有H2SO4的CuSO4 溶液完全反应后,得到m g 铜,则参与反应的CuSO4与H2SO4的物质的量之比为
| A.7:1 | B.1:7 | C.7:8 | D.8:7 |
为了检验某固体物质中是否含有NH4+,下列试纸和试剂一定用不到的是
①蒸馏水 ②NaOH溶液 ③红色石蕊试纸 ④蓝色石蕊试纸 ⑤稀硫酸
| A.①⑤ | B.④⑤ | C.①③ | D.①④⑤ |
下列各项中,表达正确的是
| A.甲醛的结构简式:HCOH | B.C2H2分子的结构式:CH≡CH |
C.CH4分子的比例模型: |
D.异丁烷的键线式: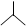 |
在杠杆的两端分别挂着质量和体积都相同的铝球和铁球,此时杠杆平衡。然后将两球分别浸没在氢氧化钠溶液和硫酸铜溶液中片刻(如下图所示),则下列说法正确的是
| A.两烧杯中均无气泡产生 | B.左边烧杯中的溶液质量减少了 |
| C.去掉两烧杯,杠杆仍平衡 | D.右边铁球上出现红色 |
关于化学反应A+B→C+D,下列说法中正确的是
A.若生成物C和D分别是盐和水,则反应物一定是酸和碱
B.若A和C是单质,B和D是化合物,则该反应一定是置换反应
C.若A是可溶性碱,B是可溶性盐,则C和D一定是两种沉淀
D.若A、B各取10 g混合,使其充分反应,则C、D质量的总和一定等于20 g
德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是
| A.水、王水、双氧水都是纯净物 |
| B.石墨和C60互为同位素 |
| C.磷酸钙中所含元素都是短周期元素 |
| D.一定条件下石墨转化为C60是化学变化 |