取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol·L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )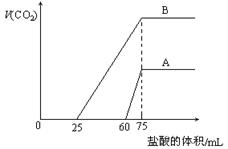
A.原NaOH溶液的物质的量浓度为0. 5mol/L
B.A线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是Na2CO3,NaHCO3
C.B线中消耗盐酸0 < v(HCl) < 25mL时发生的离子反应为: OH-+H+=H2O H++CO32-=HCO3-
D.B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为112mL
钓鱼岛群岛的东海海域及部分太平洋海域探明为海底热水矿床。海底热水矿床是沉积着由岩浆热气从地底喷出的金、铜、锌、稀有金属等区域。下列说法正确的是( )。
| A.金不溶于任何溶液 |
| B.铜、锌在空气中均能被氧化成对应的氧化物 |
| C.铜锌合金的熔点低于铜或锌的熔点 |
D.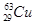 的质子数和中子数之差为34 的质子数和中子数之差为34 |
已知下列转化关系中,M、N均为单质,则M可能是( )。
M+N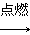 Q
Q Q溶液
Q溶液 M+N
M+N
| A.Na | B.Al | C.Fe | D.Cu |
日本地震后,导致福岛第一核电站引发核危机。核反应堆的第一层护罩是锆锡合金外壳,第二层护罩是压力仓,第三层护罩是用最坚固的钢和混凝土制成的非常厚的球体。下列叙述错误的是( )。
| A.锆锡合金、钢、混凝土都属于混合物 |
| B.钢的硬度和熔沸点都高于纯铁 |
| C.锆锡合金和钢属于金属材料,混凝土属于传统的硅酸盐材料 |
| D.在高温下,钢和水蒸气可发生反应产生氢气 |
青石棉(crocidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,青石棉的化学式为Na2Fe5Si8O22(OH)2,青石棉用稀硝酸处理时,还原产物只有NO,下列说法中正确的是( )。
| A.青石棉是一种易燃品,且易溶于水 |
| B.青石棉的化学组成用氧化物的形式可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O |
| C.1 mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗8.5 L 2 mol·L-1 HNO3溶液 |
| D.1 mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗7 L 2 mol·L-1 HF溶液 |
将含有0.1 mol SiO2的铝、硅混合物分别与足量NaOH溶液、盐酸混合,充分反应后前者可得到11.2 L气体(标准状况),后者可得到6.72 L气体(标准状况),则参加反应的n(HCl)与n(NaOH)之比为( )。
| A.1∶1 | B.1∶2 | C.2∶1 | D.3∶1 |