(13分)按要求完成下列各小题。
(1)用CO2来生产燃料甲醇的反应原理:CO2(g)+3H2(g)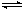 CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
CH3OH(g)+H2O(g),某些化学键的键能数据如下表:
| 化学键 |
C-C |
C-H |
H-H |
C-O |
C=O |
H-O |
| 键能/kJ·mol-1 |
348 |
413 |
436 |
358 |
750 |
463 |
计算反应上述反应的焓变△H=_______________________
写出上述反应的平衡常数表达式K=__________________,若升高温度,则平衡常数K________(填“增大”或“减小”或“不变”)。该反应的△S______0(填“>”或“<”或“=”),在 _________(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为________________。
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(3)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(4)在25℃时,将cmol·L-1的醋酸溶液与0.02mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g/cm3的混合溶液。计算:
(1)该混合溶液中NaCl的质量分数。
(2)该混合溶液中NaCl的物质的量浓度。
(3)在1000 g水中需加入________摩尔氯化钠,才能使其浓度恰好与上述混合溶液浓度相等。(保留1位小数)
有关物质的量的计算【第(4)问每空2分,其余每空1分】:
(1)2 mol CO(NH2)2中含________mol C,________ mol N,________ mol H,所含氧原子跟________g H2O所含氧原子个数相等。
(2)标准状况下有a、9.03×1023个NH3分子。b、44.8L CH4c、85g H2S气体下列对这三种气体的关系从大到小的顺序是:① 物质的量;②质量;③原子总数;④密度。(用a、b、c填空)
(3)含有相同氧原子数的CO和CO2,其质量之比为,同温同压下的体积之比为。
(4)12.4 g Na2X含有0.4 mol Na+,Na2X的摩尔质量为__________,其相对分子质量为________,X的相对原子质量为__________,该物质的化学式为_________________。
计算题:
(1)实验室用0.2L 0.5mol/L氢氧化钠溶液来吸收氯气尾气,并利用以下所给的方程式计算: 标准状况下,最多能吸收到多少升氯气?2NaOH+Cl2===NaCl+NaClO+H2O
(2)实验室配制0.5 mol·L-1硫酸溶液500 mL,需要质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为mL。
如下图所示是一密闭容器,已知A端盛2.3 g金属钠,B端盛有xg HgO,当同时加热容器的两侧支管时,钠着火燃烧,冷却后测得容器中空气成分并未发生变化,求x的值。(Hg的相对原子质量是200.6)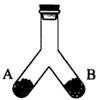
浓硫酸和铜在加热时反应,生成二氧化硫气体的体积为3.36L(标准状况下)。已知:
Cu+2H2SO4(浓)  CuSO4+SO2↑+2H2O。试计算:
CuSO4+SO2↑+2H2O。试计算:
(1)反应中消耗的铜的质量;
(2)将生成的硫酸铜配制成500mL溶液,则该溶液中CuSO4的物质的量浓度是多少?