食盐晶体如图所示。在晶体中,·表示Na+,o表示Cl-。已知食盐的密度为r g / cm3,NaCl摩尔质量M g / mol,阿伏加德罗常数为N,则在食盐晶体里Na+和Cl-的间距大约是 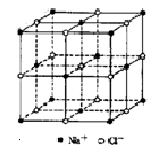
A. cm cm |
B.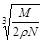 cm cm |
C.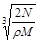 cm cm |
D.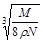 cm cm |
近年来,多地公共汽车大部分采用天然气或燃料电池作为动力,其主要目的是
| A.减少对大气的污染 | B.降低成本 |
| C.防止石油短缺 | D.加大发动机的动力 |
可逆反应:3A(g) 3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
3B(?)+C(?)(正反应为吸热反应),随着温度升高,气体平均相对分子质量有变小的趋势,则下列判断正确的是
| A.若C为固体,则B一定是气体 | B.B和C一定都是气体 |
| C.B和C可能都是固体 | D.B和C不可能都是气体 |
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
| A.该反应的△H>0 |
| B.其他条件不变,升高温度反应的平衡常数增大 |
| C.300℃时,0-t1min内 CH3OH的平均生成速率为n1/2t1 mol·L-1 min-1 |
| D.A点的反应体系从300℃升高到500℃,达到平衡时n(H2)/n(CH3OH)减小 |
如图所示曲线表示其他条件一定时,反应:2NO+O2 2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
| A.a点 | B.b点 |
| C.c点 | D.d点 |
一定温度下,可逆反应2NO2(g)  2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是
2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
| A.①④⑤⑥ | B.①②③⑤ | C.②③④⑥ | D.以上全部 |