丙烷在燃烧时能放出大量的热,它是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。
已知:①2C3H8(g) +7O2(g) =" 6CO(g)" + 8H2O(l) △H1= -2741.8kJ/mol
②2CO(g) + O2(g) = 2CO2(g) △H2= -566kJ/mol
(1)写出表示丙烷气体燃烧热的热化学方程式
(2)现有1mol C3H8在不足量的氧气里燃烧,生成1mol CO和2mol CO2以及气态水,将所有的产物通入一个固定体积为1L的密闭容器中,在一定条件下发生如下可逆反应:
CO(g) + H2O(g)  CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
5min后体系达到平衡,经测定,H2为0.8mol,则υ(H2)= ,此过程吸收的热量为_____________。
(3)对于反应CO(g) + H2O(g)  CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
CO2(g) + H2(g) △H1=" +" 41.2kJ/mol
在一个绝热的固定容积的容器中,判断此反应达到平衡的标志是 。
①体系的压强不再发生变化 ②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化 ⑥υ(CO2)正=υ(H2O)逆
有机物A(C12H15ClO3)为含多种官能团的芳香族化合物,其结构简式如图(其中虚线框内为未知部分的结构)所示,A可发生如下转化(其中部分产物已略去)。
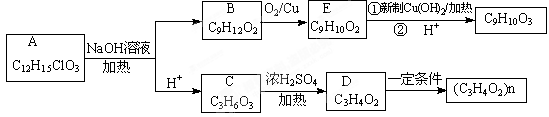
已知:D能使溴的CCl4溶液褪色;B不能与FeCl3溶液发生显色反应,1mol B最多能与2mol金属钠反应;C的催化氧化产物不能发生银镜反应。回答下列问题。
(1)写出C中官能团的名称_______________________。
(2)A的结构简式(写出一种):_________________________。
(3)写出反应类型:C→D________;B→E________。
(4)写出E与新制Cu(OH)2反应的化学方程式_____________________________________。
(5)E有多种同分异构体,满足下列条件的同分异构体有________种,写出其中任意一种同分异构体的结构简式____________。
①含有苯环且苯环上只有一个取代基;②分子结构中含有甲基;③能发生水解反应。
A~F六种有机物的相互转化关系如图所示:
据此回答下列问题:
(1)A是合成天然橡胶的单体,用系统命名法命名,A的名称为__________________,天然橡胶的结构简式为_______________。
(2)A生成 时,A发生的反应类型为____________。
时,A发生的反应类型为____________。
(3)E→F的化学方程式为__________________________。
(4)A与Br2按物质的量比1∶1发生加成反应,生成的产物有_______种(考虑顺反异构)。
(5)现有另一种有机物G,已知G与E无论按何种比例混合,只要总质量一定,完全燃烧时生成的CO2、H2O以及消耗的O2均为定值。请写出两种符合下列要求的G的结构简式___________、__________。
①M(G)<M(E);
②G的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1∶3。
按要求填写下列空白
(1)含有一个手性碳原子且式量最小的单烯烃的结构简式__________________________
(2)若分子式为C4H6的某烃中所有的碳原子都在同一直线上,则该烃的结构简式______________
(3)烯烃A是2-丁烯的一种同分异构体,它在催化剂作用下与氢气反应的产物不是正丁烷,则A的结构简式为。
(4)不能使酸性高锰酸钾溶液褪色的相对分子质量最小的苯的同系物的结构简式_______________。
【化学——选修5:有机化学基础】
(15分)有机物F是合成一种新型降压药替米沙坦的中间体,可由下图所示的路线合成:
(1)B的结构简式为:
(2)反应①→⑤中属于取代反应的是;A→B的反应类型
(3)C→D的化学方程式为。
使用过量CH3OH的作用是。
(4)E的同分异构体苯丙氨酸经聚合反应形成的高聚物是。(写结构简式)
(5)满足下列条件的B的所有同分异构体有种,
①含苯环;②含酯基;③能与新制氢氧化铜悬浊液反应生成红色沉淀。
写出其中核磁共振氢谱谱图中吸收峰个数最少的有机物结构简式:。
【化学——选修3:物质结构与性质】已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素。其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的正三价离子的3d亚层为半充满状态。请根据上述情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
(1)元素B、C的第一电离能的大小关系是(用元素符号填写),其原因为。
(2)A的的某种氢化物A2H2分子的空间构型是,其中心A原子采取的杂化形式为,分子中含有个 键,个
键,个 键。
键。
(3)写出E原子的核外电子排布式是,用电子式表示化合物DC的形成过程。
(4)由E元素形成的金属的晶胞结构如图,已知该晶胞边长为a厘米,该晶体的密度为。(用NA表示阿伏伽德罗常数的值)
(5)配合物E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于(填晶体类型)。