在一定温度下,容器内某一反应中 M 、N 的物质的量随反应时间变化的曲线如右图,下列表述中正确的是( )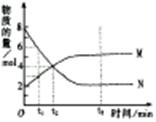
A.反应的化学方程式为:2M N N |
| B.t2时,正逆反应速率相等,达到平衡 |
| C.t3时,正反应速率大于逆反应速率 |
| D.t1时,N 的浓度是 M 浓度的 2倍 |
要防止水体污染,改善水质,最根本的措施是()。
| A.控制工业废水的排放 |
| B.对河水进行消毒处理 |
| C.控制农田排水 |
| D.减少用水量 |
水是人类最宝贵的资源,我国是淡水资源最贫乏的国家之一,节约用水已成为全国人民的共识。下列不符合节约用水的做法是( )。
| A.农田普及滴灌技术 |
| B.鼓励超量开采地下水,以补充城市水资源紧缺 |
| C.工厂废水经处理用于城市绿化或农业灌溉 |
| D.减少污染源,保护水源地不被污染 |
据报道,汉江流域再次发生“水华”现象,江面上有大量绿色漂浮物,类似于海面上的“红潮”,取水样分析:绿藻含量比正常情况下偏高很多,含氧量明显偏低,浑浊度增加。造成汉江“水华”最可能的原因是( )。
| A.水土流失 |
| B.有毒的废水大量排入汉江 |
| C.生活废水大量排入汉江,使水质富营养化 |
| D.汉江流域农业生产中长期使用农药 |
近年来赤潮在我国时有发生,当赤潮发生时,海水中的某些微小浮游生物大量繁殖,使水体呈现红、紫等颜色,并对生物造成危害。下列说法中不正确的是( )。
| A.赤潮是水体富营养化的结果 |
| B.含磷洗涤剂的广泛使用与排放是赤潮发生的主要原因 |
| C.在封闭的海湾更容易发生赤潮 |
| D.赤潮现象为鱼类等提供了大量食物,有利于它们的大量繁殖与生长 |
江水受到污染,其污染的主要原因是( )。
①工业生产中废液的任意排放 ②雨水和土壤的长期接触 ③农业生产中农药、化肥的过量施用 ④城市生活污水的任意排放
| A.①②③ | B.②③④ | C.①③④ | D.①②③④ |