做铁丝在氧气中燃烧的实验时应该在集气瓶底放上 或 ,目的是 。
构建安全体系,建设小康社会,关系国计民生。近期,媒体报道的某些环境问题、卫生问题和安全问题引发了人们的关注:
(1)据报道:"济南俩月查处了13家'铝包子'铺",所谓'铝包子'是指所用面粉中非法加入了含有硫酸铝铵
成分的泡打粉,食物中铝元素超标,危害身体健康。在硫酸铝铵中,所含非金属元索共有种。
(2)露天烧烤不仅污染环境、导致周边空气中PM2.5指数严重超标,在烧烤的肉类食物中还含有强致癌物质一一苯并 (a) 芘(化学式为
),在苯并 (a) 芘中,氢元素与碳元素的原子个数之比为(填最筒整数比)。
(3)据报道:2015年5月6日在104国道某段,一辆载有20多吨浓硫酸的罐车不慎侧翻,造成大量硫酸泄漏。有关部门调来大量熟石灰粉[主要成分为
]和沙土用于清除泄漏的硫酸。试写出硫酸和熟石灰反应的化学方程式:。
(4)世界卫生组织将5月3 1日定为"世界无烟日",我国采取了公共场所禁止吸烟等控烟措施。吸烟有害健康,我国遭受二手烟危害的非吸烟人口就多达7.4亿。烟雾中主要含有一氧化碳、尼古丁(
)和焦油,这三种物质被称为香烟的三大杀手。下列有关说法中,正确的是(填写序号A、B、C、D之一)
①生活中应拒绝毒品
②焦油能诱发细胞病变
③吸烟对他人无害
④"煤气"中毒是由一氧化碳引起的
⑤在尼古丁中氮元素的含量最高
A.①④⑤ B.①②③ C.①②④ D.②③⑤
按要求从氧气、硫酸钡、碳酸、氨气、氢氧化镁、氧化钙中选择合适的物质,将其化学式填写在下列横线上。
(1)一种有刺激性气味的气体;
(2)一种难溶于水的碱;
(3)一种能供给呼吸的单质;
(4)一种易分解的酸。
含锌废渣和各种锌矿(如菱锌矿)都有着重要的用途
I.以含锌废渣(主要成分为
,杂质为
﹑
)为原料制备七水硫酸锌(
)的流程如下。
(1)粉碎的目的是。
(2)若实验室用质量分数为98%的硫酸配制200g25%的硫酸,需要的玻璃仪器有胶头滴管﹑玻璃棒﹑和,此处玻璃棒的作用是。
(3)物质X是,滤渣中含有的金属单质有,除铜时发生的反应属于反应(填基本反应类型)。
(4)流程中获得七水硫酸锌前省略的操作是﹑冷却结晶﹑洗涤和低温烘干。
(5)某温度下,
分解得到一种铁﹑氧质量比21:8的氧化物,该氧化物的化学式。
(6)除铁过程中,温度pH对除铁效果的影响分别对如图所示。由图可知,除铁时温度应控制在℃为宜,pH应控制在为宜。
II.以某菱锌矿(
含量为62.5%)为原料制备锌的原理如下(假设杂质不参加反应):
则100吨这样的菱锌矿理论上最多制得锌多少吨?(写出计算过程)
醋酸钙
是国家允许使用的补钙制剂之一。以蛋壳为原料回收膜并制备醋酸钙的一种工艺流程如下。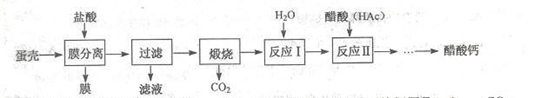
(1)写出煅烧时的化学方程式。
的任意排放会引发的环境问题是。
与
一定条件下化合生成甲醛(
),则此反应中与最佳质量比是。下列做法能减少二氧化碳排放的是。(填序号)
(2)在反应I中制备石灰乳,而不是制备澄清石灰水的目的是。写出熟石灰的一种用途
(3)在反应II中醋酸过量的目的是。写出反应II的化学方程式。
(4)膜分离时,盐酸不能过量的主要原因是。
一定条件下, 与 反应会生成三种氧化物。某兴趣小组用如下装置探究该反应。
已知
,
均能使澄清石灰水变浑浊。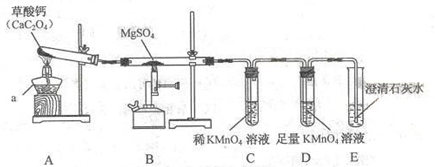
(1)仪器的名称是
。
中
的化合价是。
(2)装置
中
的分解会生成一种气体和一种相对分子质量为100的盐,则
中反应的反应化学方程式。
(3)实验时观察到装置
中紫红色褪去,装置
中溶液变浑浊,则在
和
中反应的气体分别是﹑。
(4)装置
中反应的化学方程式是。装置
的作用是。
(5)该装置的明显不足之处是。