25℃时,向10mLpH=12的某碱溶液中加入10mLpH=2的盐酸,充分反应后滴入石蕊试液,溶液显蓝色,则此碱一定是( )
| A.弱碱 | B.一元强碱 | C.多元强碱 | D.任何强碱 |
青蒿素是一种高效、速率搞疟药,是中医献给世界的一份礼物。其结构简式如图所示。下列有关青蒿素的说法正确的是
| A.易溶于乙醚等有机溶剂 |
| B.分子式为C15H21O5 |
| C.能在热的NaOH溶液中存在 |
| D.分子结构中只含有极性键 |
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如图所示,下列说法正确的是
| A.该有机物的分子式为C7H7O3 |
| B.1mol该有机物最多能与2mol H2发生加成反应 |
| C.该有机物能发生取代、加成和氧化反应 |
| D.该有机物的一种含苯环的同分异构体能发生银镜反应 |
某种可充电聚合物锂离子电池放电时的反应为Li1﹣xCoO2 + LixC6 =" 6C" + LiCoO2,其工作原理示意图如图。下列说法不正确的是
| A.放电时LixC6发生氧化反应 |
| B.充电时将电池的负极与外接电源的负极相连 |
| C.充电时,Li+通过阳离子交换膜从左向右移动 |
| D.放电时,电池的正极反应为:Li1﹣xCoO2+xLi++xe﹣═LiCoO2 |
有机物Q的分子式为C5H10O2,一定条件下Q遇NaHCO3、Na均能产生气体,且生成气体体积比(同温同压)为2:1,则Q的结构最多有
| A.4种 | B.6种 | C.8种 | D.7种 |
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)  Y(g)+ Z(g) △H<0容器内气体总压强p随反应时间t的变化关系如图所示。 以下分析正确的是
Y(g)+ Z(g) △H<0容器内气体总压强p随反应时间t的变化关系如图所示。 以下分析正确的是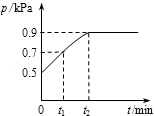
| A.从反应开始到t1时的平均反应速率v(X) = 0.2/t1 mol/(L•min) |
| B.该温度下此反应的平衡常数K = 0.32 |
| C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 |
| D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |