在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)  Y(g)+ Z(g) △H<0容器内气体总压强p随反应时间t的变化关系如图所示。 以下分析正确的是
Y(g)+ Z(g) △H<0容器内气体总压强p随反应时间t的变化关系如图所示。 以下分析正确的是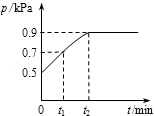
| A.从反应开始到t1时的平均反应速率v(X) = 0.2/t1 mol/(L•min) |
| B.该温度下此反应的平衡常数K = 0.32 |
| C.欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 |
| D.其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
某醇R-CH2-CH2-OH分子中化学键如下所示,则下列说法错误的是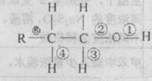
| A.发生催化氧化反应时,被破坏的键是①和③ |
| B.发生消去反应时,被破坏的键是②和④ |
| C.发生酯反应时,被破坏的键是② |
| D.与HX发生取代反应时,被破坏的键② |
盖斯定律在生产和科学研究中有很重要的意义。已知3.6g碳在6.4g氧气中燃烧,至反应物耗尽,放出了X kJ热量。已知碳完全燃烧的焓变△H= 一Y kJ·mol-1,则lmol C与O2反应生成CO的反应热△H为 ( ) kJ·mol-1
| A.一Y | B.—(10X—Y) | C.一(5X—O.5Y) | D.+(10X—Y) |
在2KI+O3+H2O=2KOH+I2+O2的反应中,当有2摩尔的KI被氧化时,被还原的氧原子为
| A.lmol | B.1/2mol | C.2/3mol | D.1/3mol |
下列离子方程式正确的是
| A.NH4C1溶液与NaOH溶液混合混和: OH-+NH4++CI-=NH3·H2O+Cl- |
| B.稀硫酸滴在铜片上: Cu+2H+=Cu2++H2↑ |
| C.稀硫酸与氢氧化钡溶液混和: H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| D.过量氯气通入溴化亚铁溶液中: 3Cl2+4Br-+2Fe2+=2Br2+2Fe3++6CI- |
五颜六色的颜色变化增添了化学的魅力,对下列有关反应的颜色叙述正确的是:①新制氯水久置后→浅黄绿色消失;②淀粉溶液遇单质碘→蓝色;③溴化银见光分解→银白色;④热的黑色氧化铜遇乙醇→红色;⑤鸡蛋白溶液遇浓硝酸→黄色;⑥苯酚在空气中氧化→粉红色
| A.①②③④⑤ | B.②③④⑤⑥ | C.①②④⑤⑥ | D.①⑧④⑤⑥ |