下列做法中不会对人体造成危害的是( )
| A.在不通风、无防护的条件下用苯做实验 |
| B.用福尔马林(35%-40%甲醛水溶液)浸泡海产品,防腐保鲜 |
| C.用食醋除去水壶内壁的水垢 |
| D.将含有甲醇(CH3OH)的工业酒精兑制成饮用白酒出售,以提高利润 |
将足量稀盐酸加到下列固体混合物中,只能发生一种反应的是
| A.Mg、AlCl3、NaAlO2 | B.KNO3、NaCl、CH3COONa |
| C.NaClO、Na2SO3、BaCl2 | D.Ba(NO3)2、FeSO4、NH4HCO3 |
氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3 ="" N2+6HCl检查氯气管是否漏气。下列说法错误的是
| A.若管道漏气遇氨就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 | D.生成1 mol N2有6 mol电子转移 |
潮湿的氯气、新制的氯水、次氯酸钠及漂白粉的水溶液均能使有色布条褪色,原因是它们均含有
| A.氯气 | B.次氯酸 | C.次氯酸根 | D.氯化氢 |
设NA 代表阿伏加德罗常数的数值,下列说法正确的是
A.1 mol 硫酸钾中阴离子所带电荷数 为NA 为NA |
| B.标准状况下,NA个SO3分子所占的体积约为22.4 L |
| C.标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
D.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA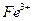 |
将下列晶体熔化:氢氧化钠、二氧化硅、氧化钙、四氯化碳,需要克服的微粒间的相互作用①共价键②离子键③分子间作用力,正确的顺序是
| A.①②②③ | B.②①②③ | C.②③②① | D.①①②③ |