用18mol/L的浓硫酸配制100mL 1mol/L硫酸:
(1)用量筒量取浓硫酸的体积应为 mL,将浓硫酸缓缓倒入盛水的烧杯中后__ __ (填“应该”或“不应”)用少量蒸馏水洗涤量筒2~3次并将洗涤溶液也倒入烧杯中。
(2)若实验仪器有: A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F. 胶头滴管 G. 50mL烧杯 H. 100mL容量瓶
验时应选用的仪器有(填入编号) 。
(3)定容时,若俯视液面,则所配溶液浓度 ____ (填“偏高”、“偏低”或“无影响”);若不小心加水超过了容量瓶刻度线,应 。
A.用胶头滴管将多余溶液吸出 B.加热容量瓶使水挥发 C.重新配制
下图为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置)。
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质。装置①用于实验室制备NH3,用装置②制备过量O2。装置①中发生反应的化学方程式是。B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因。
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现。C中若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将上述装置A、B、C分别换成下列⑤、⑥、⑦。
请回答:装置⑦的作用可能是;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是。
碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-═2SO42-+I2(慢),I2+2S2O32-═S4O62-+2I-(快),
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变成为色。为确保能观察到该现象,S2O32—与S2O82—初始的物质的量需满足的范围为:n(S2O32—):n(S2O82—)。
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表: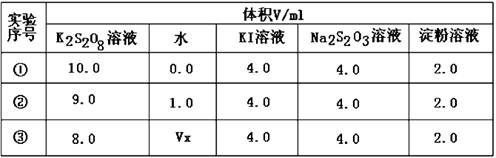
表中Vx=mL,反应速率最快的是(填序号)。
(3)已知图中A曲线为某条件下,浓度c(S2O82—)~反应时间t的变化曲线图,若保持
其他条件不变,(填“B”或“C”)曲线为降低反应温度,(填“B”或“C”)曲线为加入催化剂。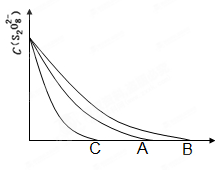
过氧化钙(CaO2)常用作种子消毒剂、药物制造、油脂漂白及高温氧化剂,还可以作为鱼池增氧剂。将SO2通入过氧化钙固体粉末中有气体生成。有人提出:CO2、SO2与过氧化钙的反应原理相同结果有O2生成;但也有人提出:SO2具有较强的还原性,CO2无强还原性,反应原理不相同无O2生成。 据此设计如下实验操作进行判断。
实验一、通过气体体积的测量判断发生的化学反应,实验装置如下:
(1)请写出b的仪器名称。
(2)试剂A可以选用,试剂B的作用是。
(3)检查装置A的气密性的操作方法是。
实验二、向一定量的过氧化钠固体中通入足量SO2,取反应后的固体进行实验探究,以证明过氧化物与SO2反应的特点。
(4)提出假设:
假设1:反应后固体中只有Na2SO3,SO2未氧化;
则写出反应的化学方程式:。
假设2:反应后固体中只有,SO2完全氧化;
则写出反应的化学方程式:。
已知非金属单质硫是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是,烧瓶中加入的试剂是。
(2)画出虚线框内的实验装置图,并注明所加试剂,说明装置的作用。
(3)装置B中盛放的试剂是(选填下列所给试剂的代码),实验现象为,反应的化学方程式为。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。
(5)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,该反应的离子方程式为。
已知:SO2可以与硫酸酸化的浓KMnO4溶液反应,也可以使澄清的石灰水变浑浊。下图④中浓硫酸与木炭粉在加热条件下发生反应生成CO2、SO2和H2O。
(1)在加热条件下,浓硫酸与木炭粉反应的化学方程式是:。
(2)若用上图所列各装置设计一个实验,验证浓硫酸与木炭粉反应的产物,这些装置的连接顺序
(按产物气流从左至右的方向)是(填装置的编号)→→→。
(3)B瓶溶液的作用是。本实验中能说明二氧化硫具有漂白性的实验现象是。③中反应的离子方程式为。
(4)装置②中所盛是无水硫酸铜,现象是。