有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl-离子完全沉淀。反应中消耗xmolH2SO4 、ymol AgNO3溶液。据此得知原混合液中氯化钠的物质的量浓度(mol/L)为( )
| A.(y-2x)/a | B.(y-x)/a | C.(2y-2x)/a | D.(2y-4x)/a |
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图,电解总反应为:2Cu+H2O=Cu2O+H2↑。下列说法正确的是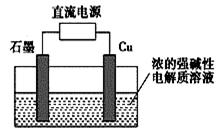
| A.石墨电极上产生氢气 |
| B.铜电极发生还原反应 |
| C.铜电极接直流电源的负极 |
| D.当有0.1 mol 电子转移时,有0.1 mol Cu2O生成 |
t℃时,在两个相同的密闭刚性容器(等容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g) 2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
数据分析发现:达到平衡时,化学状态Ⅰ和化学状态Ⅱ完全相同。下列叙述不正确的是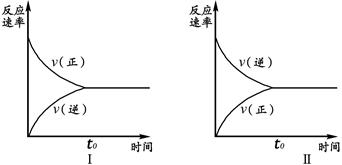
| A.若实验ⅠSO2的起始浓度为1mol/L,则实验ⅠO2的起始浓度为0.5mol/L;实验ⅡSO3的起始浓度为1mol/L. |
| B.若实验ⅠSO2的转化率为a%,则实验ⅡSO3 的转化率为1-a%。 |
| C.若起始浓度C(SO2) m mol/L,C(O2)=" n" mol/L,C(SO3)=" p" mol/L,在相同条件下进行实验,要求达到平衡时的状态与实验Ⅰ、Ⅱ完全相同,则m、n、p必须满足的条件是m/n="2" 和 m+p=1。 |
| D.维持实验Ⅰ的起始浓度和实验温度不变,改密闭刚性容器为密闭可变体积容器(等压容器)进行实验,达到化学平衡时:SO2的转化率与实验Ⅰ中SO2的转化率相比要小,但正反应速率与实验Ⅱ相比要大。 |
现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
| A.④①②⑤⑥③ | B.④①②⑥⑤③ | C.①④②⑥③⑤ | D.①④②③⑥⑤ |
常温下,对于①pH =12氨水②0.05 mol/L盐酸③pH =13的NaOH溶液④0.1 mol/L AlCl3溶液,下列说法正确的是
| A.①与②以体积比1:1混合,所得溶液中显酸性 |
| B.③与④以体积比1:4混合,会发生如下反应Al3++3OH-=Al(OH)3↓(胶体),故所得溶液能够净水 |
| C.②与③以体积比3:2混合,形成溶液的pH=2 |
| D.②与④以体积比2:1混合,所得溶液中c(H+)>c(Al3+) |
茉莉醛具有浓郁的茉莉花香,其结构简式如下所示:关于茉莉醛的下列叙述错误的是
| A.在加热和催化剂作用下,能被氢气还原 |
| B.能被高锰酸钾酸性溶液氧化 |
| C.在一定条件下能与溴发生取代反应 |
| D.不能与氢溴酸发生加成反应 |