甲、乙、丙、丁、戊分别是Na2SO4、Ba(NO3)2、HNO3、BaCl2、NaOH五种溶液中的一种,现利用X溶液鉴别它们,试根据下图关系回答问题: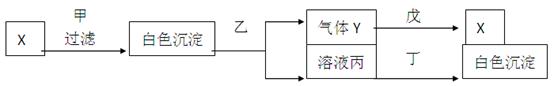
写出下列物质的化学式:
甲: ;乙: ;丙: ;
丁: ; X: 。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。
CH3OH(g)+H2O(g),右图表示该反应进行过程中能量的变化。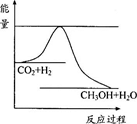
(1)关于该反应的下列说法中,正确的是_______。
| A.△H>0,△S>0; | B.△H>0,△S<0; |
| C.△H<0,△S<0; | D.△H<0,△S>0。 |
(2)该图中能量的最高点和最低点之间的差值代表
(3)以CH4和H2O为原料,通过下列反应来制备甲醇。
①CH4(g)+H2O(g) ="=" CO(g)+3H2(g) △H=+206.0KJ/mol
②CO(g) + 2H2(g) = CH3OH(g) △H=-129.0KJ/mol
CH4(g)和H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为 。
合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g)∆H= —92.4kJ•mol‾1一种工业合成氨的简易流程图如下:
2NH3(g)∆H= —92.4kJ•mol‾1一种工业合成氨的简易流程图如下:
(1)天然气中的H2S杂质常用氨水吸收,写出氨水的电离方程式 。吸收产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出吸收液再生反应的化学方程式 。
(2)步骤II中制氢气原理如下:
①CH4(g)+H2O(g)  CO(g)+3H2(g) △H=+206.4 kJ·mol-1
CO(g)+3H2(g) △H=+206.4 kJ·mol-1
②CO(g)+ H2O(g)  CO2(g)+H2(g) △H=-41.2 kJ·mol-1
CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则反应CH4(g)+2H2O(g)  CO2(g)+4H2(g) △H= kJ·mol-1。
CO2(g)+4H2(g) △H= kJ·mol-1。
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是(填编号) 。
a.升高温度b.增大水蒸气浓度c.加入催化剂d.降低压强
(3)利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O蒸气反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
(4)下图1表示500℃、60.0MPa条件下,H2和N2为原料气的投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数为 。
(5)依据温度对合成氨反应的影响,在下图2坐标系中,画出一定条件下的密闭容器内,从通入起始原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。
图1图2
(6)简述本流程中提高合成氨原料总转化率的方法 。
(Ⅰ)浓硝酸与浓盐酸混合过程中会产生少量的黄绿色气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构。2mol M加热分解生成1mol氧化产物X和2mol无色气体Y,Y遇到空气呈现红棕色。
(1)镁与气体X反应产物的电子式 。
(2)浓硝酸与浓盐酸反应的化学方程式为 。
(3)化合物M水解生成两种酸,为非氧化还原反应,该反应的化学方程式为 。
(Ⅱ)石油铁储罐久置未清洗易引发火灾,经分析研究,事故是由罐体内壁附着的氧化物甲与溶于石油中的气态氢化物乙按1︰3反应生成的物质丙自燃引起的。某研究小组将一定量的丙粉末投入足量的浓盐酸中发生反应,得到4.8g淡黄色固体和气体乙,乙在标准状况下的密度为1.52g·L-1。过滤后向滤液(假设乙全部逸出)中加入足量的NaOH溶液,先出现白色沉淀,最终转变为红褐色沉淀,过滤、洗涤、灼烧后的固体质量为24g。已知气体乙可溶于水。请回答下列问题:
(4)甲的化学式为 。
(5)丙在盐酸中反应的化学方程式为 。
(6)丙与盐酸反应后的滤液暴露在空气中一段时间颜色加深,其原因是(用离子方程式表示) 。
(7)为消除石油铁储罐的火灾隐患,下列措施可行的是(填编号) 。
| A.石油入罐前脱硫 | B.定期用酸清洗罐体 |
| C.罐体内壁涂刷油漆 | D.罐体中充入氮气 |
工业上接触法制硫酸过程中,在沸腾炉中煅烧硫铁矿(主要成分为FeS2)的化学方程式为:4 FeS2 + 11O2  2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
请回答下列问题:
(1)已知S为 -1价,则被氧化的元素是 。
(2)若煅烧1.0 t的硫铁矿(杂质含量为30%,杂质中不含硫元素),且FeS2的转化率为90%,则标准状况下,生成的SO2体积为 m3。
(3)若硫铁矿煅烧不充分,则炉渣中混有+2价的铁元素,试设计一个简单的实验证明之。简述实验操作和有关的实验现象 。
供选择的试剂:CuSO4溶液、稀硫酸、KMnO4溶液、品红溶液、NaOH 溶液等
(4)炉渣经提纯可制得FeCl3,电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路版。请写出FeCl3溶液与铜反应的化学方程式 。检验反应后的溶液中存在Fe3+的试剂可用 。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,下列试剂中,需要用到的一组是(填字母) 。
①蒸馏水 ②铁粉 ③浓硝酸 ④稀盐酸 ⑤浓氨水 ⑥氯水
| A.①②④⑥ | B.①③④⑥ | C.②④⑤ | D.①④⑥ |
(1)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为aL,达到平衡时,V(B)=0.8aL,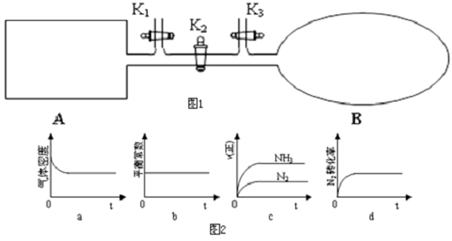
①图2示意图中正确,且既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是______。
②A、B中N2转化率的关系:α(A) ___α(B)(填“>”、“<”或“=”);
③打开K2,一段时间又达到平衡时,B的体积为_____L(连通管中气体体积不计)
(2)某研究小组对一元有机弱酸HA在溶剂苯和水的混合体系中溶解程度进行研究,在25℃时,弱酸HA在水中部分电离,当HA浓度为4.0×10-3mol•L-1时,其电离度为0.30;在苯中部分发生双聚,生成(HA)2.该平衡体系中,一元有机弱酸HA在溶剂苯(B)和水(W)中的分配系数为K,K=c(HA)B/c(HA)W=1.0,即达到平衡后,以分子形式存在的HA在苯和水两种溶剂中的比例为1:1;其他信息如下:
| 25℃平衡体系 |
HA起始总浓度 |
在水中,HA H++A- H++A- |
4.0×10-3mol•L-1 |
在苯中,2HA (HA)2 (HA)2 |
5.0×10-3mol•L-1 |
则25℃,在苯体系中HA的转化率为___________