某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A (g)+xB(g) 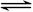 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的如下图所示。下列说法中正确是( )
| A.8min前A的平均反应速率为0.08mol/(L·s) |
| B.30min时扩大容器的体积,40min时升高温度 |
| C.反应方程式中的x=1,正反应为吸热反应 |
| D.30min和54min的反应的平衡常数相等4 |
石头纸(Rich Mineral Paper)也叫石科纸,就是用磨成粉末的石头为主要原料,加上15%的聚乙烯和5%胶合剂制成的。2010年两会期间,与会的政协委员们领到的各种会议资料都是以碳酸钙为主要原料的低碳“石头纸”。下列有关“石头纸”的说法错误的是
| A.“石头纸”不宜在高温条件下生产 |
| B.“石头纸”与普通纸相比不易燃烧 |
| C.“石头纸”能耐强酸与强碱的腐蚀 |
| D.推广使用“石头纸”能达到保护森林和环保的目的 |
下列表示物质结构的化学用语或模型图正确的是
A.H2O2的电子式: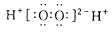 |
B.O2-的结构示意图: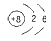 |
| C.二氧化硅的分子式:SiO2 |
D.质子数为8,中子数为10的氧原子: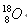 |
设NA是阿伏加德罗常数的数值,下列说法正确的是
| A.1molAl3+离子含有的核外电子数为3NA |
| B.1molCl2与足量的铁反应,转移的电子数为3NA |
| C.46gNO2和N2O4混合气体中含有原子总数为3NA |
| D.标准状况时1LpH=13的NaOH溶液中含有的OH-离子数为0.1NA |
以色列科学家达尼埃尔·谢赫特曼因发现“准晶体”而独享2011年诺贝尔化学奖。1982年谢赫特曼首次观察到一种“准晶体”现象,“准晶体”原子结构打破了传统晶体内原子结构必须具有重复性这一黄金法则,在当时引起极大争议,并被迫离开当时的研究小组。但随后,科学家们在实验室中制造出了越来越多的各种准晶体,并于2009年首次发现了纯天然准晶体。下列认识错误的是
| A.科学家开创性的发现是决定科学发展的唯一途径 |
| B.实验是科学发现的重要手段,科学发现往往需要建立在实验事实的基础之上 |
| C.人类对物质结构的探索是无止境的,对物质世界的认识也是不断深入的 |
| D.最伟大的科学家也会陷于传统藩篱的桎梏中,保持开放的头脑、敢于质疑现有认知是科学家最重要的品质 |
下列离子方程式中,正确的是
| A.稀硫酸与NaOH溶液反应2H++OH-=H2O |
| B.AgNO3溶液与NaCl溶液反应 Ag++Cl-=AgCl↓ |
| C.CaCO3与稀盐酸反应 CO32-+2H+=CO2↑+H2O |
| D.Fe片插入FeCl3溶液中 Fe+Fe3+=2Fe2+ |