(16分)某同学利用下列装置实现铜与浓硝酸、稀硝酸反应,过程如下:
I.取一段铜丝,用稀硫酸除去铜锈[主要成分是Cu2(OH)2CO3]。
Ⅱ.将洗涤后的铜丝做成匝数较多的螺旋状。
III.按如图所示装置连接仪器、检查气密性、装入化学试剂。
(1)过程I发生反应的离子方程式是 。
(2)写出过程III中检查气密性的方法 。
⑶过程III的后续操作如下:
①打开止水夹a和b,轻推注射器,使浓硝酸与铜丝接触,观察到的现象是 ,一段时间后使反应停止的操作是 ,关闭a,取下注射器。
②打开b和分液漏斗活塞,当玻璃管充满稀硝酸后,关闭b和分液漏斗活塞,打开a,观察到有气泡产生。稀硝酸充满玻璃管的实验目是 ,该反应的离子方程式是 。
(4)另取3支盛满NO2气体的小试管分别倒置在盛有常温水、热水和冰水的3只烧杯中,发现液面上升的高度明显不一致。结果如下表所示(忽略温度对气体体积的影响):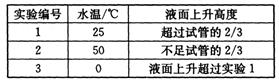
①根据上表得出的结论是温度越 (填“高”或“低”),进入试管中的溶液越多。
②查阅资料:
a.NO2与水反应的实际过程为:2NO2+H2O=HNO3+HNO2 3HNO2 =HNO3+2NO+H2O;
b.HNO2不稳定。
则产生上述现象的原因是 。
用98%的浓H2SO4(ρ=1.84g/cm3)配制240mL0.5mol/L的稀H2SO4,请按要求填空:
(1)所用浓H2SO4的物质的量浓度为 ,配制时所需浓硫酸的体积为mL。(均保留一位小数)
(2)实验中需要用到的定量仪器有。
(3)若实验中出现下列现象对所配溶液的浓度有什么影响?(填“偏高”、“偏低”或“无影响”)
①浓硫酸溶解后未冷至室温即进行转移、定容。()
②定容时俯视刻度线。()
(4)若定容时液面高于刻度线应采取的措施是。
(5)若实验操作全部无误,最后所得的溶液应存放在试剂瓶中,并贴上标签,请你帮助把标签上的内容写一下(如右图)。
在标准状况下,将224LHCl气体溶于635mL水中(水的密度为1 g/cm3)
所得盐酸的密度为1.18g/cm3,回答下列问题:
(1)该盐酸溶液的质量分数为;该盐酸溶液的物质的量浓度为。
(2)实验室利用该盐酸来配制250mL0.5mol/L的稀盐酸,从下列用品中选出实验所需要的仪器或用品______________(填序号)
a .胶头滴管b.10mL量筒c.20mL量筒 d. 100mL容量瓶
.胶头滴管b.10mL量筒c.20mL量筒 d. 100mL容量瓶
e.玻璃棒f.1000mL容量瓶 g.广口瓶 h.托盘天平
除选用上述仪器外,尚缺少的仪器或用品是__ ______。需取用原盐酸mL。
(3)下列操作对所配溶液的浓度有何影响?(答偏高、偏低、无影响)
①转移一次后,将洗涤烧杯的残液倒入废液缸中:。
②定容时仰视容量瓶:。
③定容后,加盖倒转摇匀后观察,发现液面低于刻度线: 。
。
用18 mol/L 的浓硫酸配制100 ml 3.0 mol/L 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸③溶解
④检漏 、转移、洗涤⑤定容、摇匀
、转移、洗涤⑤定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是,量取浓硫酸所用的量筒的规格是(用下列编号填空)。
| A.10ml | B.25ml | C.50ml | D.100ml) |
(2)第③步实验的操作是
(3)第⑤步实验的操作是继续向容量瓶中注入蒸馏水至离刻度线;改用向容量瓶中滴加蒸馏水至为止。塞紧瓶塞,倒转摇匀并装试剂瓶。
(4)检验试剂瓶中的溶液含有SO42-的操作是
(5)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
①容量瓶用蒸馏水洗涤后残留有少量的水;
②所用过的烧杯、玻璃棒未洗涤;
③加水超过刻度线后,用胶头滴管吸出多余的液体。
实验室要配制100 mL 0.5 mol·L-1的NaCl溶液,试回答下列各题:
(1)下列仪器中,肯定不会用到的是 ()
A.锥形瓶 B.200 mL容量瓶 C.量筒 D.胶头滴管 E.100 mL容量瓶 F.天平
(2)若要实施配制,除上述仪器外,还缺少的仪器或用品是____________________。
(3)容量瓶上除有刻度线外还应标有_________________,容量瓶在使用前必须进行的一步操作是_________________________。
(4)配制完毕后,老师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作会导致所得溶液浓度偏高的是( )
A.定容时仰视容量瓶刻度线 B.定容时俯视容量瓶刻度线
C.将溶解冷却后的溶液直接转入容量瓶后就进行定容操作
D.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
(5)通过计算可得出可用托盘天平称取NaCl固体________克。若用4 mol/L的NaCl浓溶液配制100 mL 0.5 mol·L-1的稀溶液,应用量筒量取_________mL该浓溶液。
(7分) 右图为实验室制取蒸馏水的装置示意图,根据图示回答下列问题。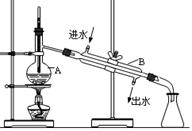
(1)图中的两处明显的错误是
①;②。
(2)A仪器的名称是____________,
B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,为防止 液体暴沸还需加入少量_______。