实验室欲配制0.5 mol·L-1的NaOH溶液500 mL有以下仪器:①烧杯②100 mL量筒③1 000 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有(填代号) ,还缺少的仪器是
(2)需称量 g烧碱固体,固体应放在 中称量。
(3)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为 。
(4)在配制过程中,其他操作都正确,下列操作会引起误差偏高的是 。
| A.未洗涤烧杯、玻璃棒 |
| B.未等NaOH溶液冷却至室温就转移到容量瓶中 |
| C.容量瓶不干燥,含有少量蒸馏水 |
| D.定容时俯视标线 |
E、摇匀后液面下降,补充水
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。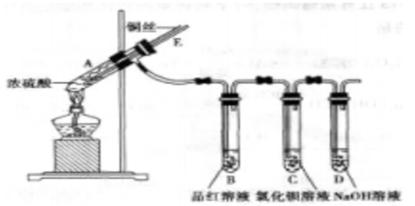
实验步骤:
①先连接好装置,检查气密性,再加入试剂;
②加热A试管,B中品红溶液褪色,熄灭酒精灯;
③将铜丝向上抽动离开液面。
(1)试管中发生反应的化学方程式为_____________________________.
(2)能够证明铜与浓硫酸反应生成气体的现象_________________________.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其分成两份,分别滴加下列溶液,将产生沉淀的化学式填入下表相应的位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
__________ |
______________ |
写出其中SO2显示还原性的反应的离子方程式___________________.
(4)实验完毕后,先熄灭酒精灯,由于导管E存在,B中的液体不会倒吸入A中,其原因是___________________________________________.
(5)实验完毕后,装置中残留气体有毒,不能打开胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是_______________________.
溴苯是一种常用的化工原料。实验室制备溴苯的实验步骤如下:
步骤1:在a中加入15 mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中,充分反应。
步骤2:向a中加入10 mL水,然后过滤除去未反应的铁屑。
步骤3:滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL 水洗涤,分液得粗溴苯。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品。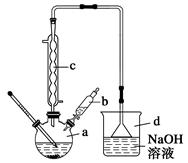
| 苯 |
溴 |
溴苯 |
|
| 密度/g·cm-3 |
0.88 |
3.10 |
1.50 |
| 沸点/℃ |
80 |
59 |
156 |
| 在水中的溶解度 |
微溶 |
微溶 |
微溶 |
(1)仪器d的作用是。
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是。
(3)仪器c的作用是冷凝回流,回流的主要物质有(填化学式)。
(4)步骤4得到的粗产品中还含有杂质苯。已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是。
(实验班做)已知碳化铝(Al4C3)与水反应生成氢氧化铝和甲烷。为了探究甲烷性质,某同学设计如下两组实验方案;甲方案探究甲烷与氧化剂反应(如图1所示);乙方案探究甲烷与氯气反应的条件(如图2所示)。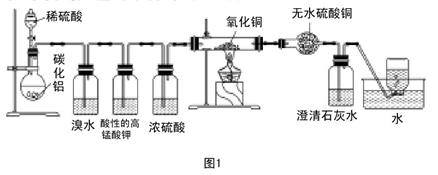
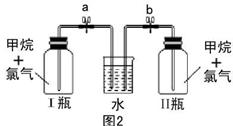
甲实验现象:溴水无颜色变化,澄清石灰水变浑浊,无水硫酸铜变蓝色。乙实验操作过程:通过排饱和食盐水的方法收集两瓶甲烷与氯气(体积比为1∶4)混合气体(I、II),II瓶用预先准备好的黑色纸套套上,I瓶放在光亮处(不要放在日光直射的地方,以免引起爆炸)。按图2安装好装置,并加紧弹簧夹a和b。
(1)写出碳化铝与硫酸反应的化学方程式。
(2)实验甲中浓硫酸的作用是,集气瓶中收集到的气体能否直接排入空气中?(填“能”或“否”)。
(3)下列对实验甲有关现象与结论的叙述都正确的是()
| A.酸性高锰酸钾溶液不褪色,结论是通常条件下,甲烷不能与强氧化剂反应 |
| B.硬质试管里黑色粉末无颜色变化,结论是甲烷不与氧化铜反应 |
| C.硬质试管里黑色粉末变红色,推断氧化铜与甲烷反应只生成水和二氧化碳 |
| D.甲烷不能与溴水反应,推知甲烷不能与卤素单质反应 |
(4)写出硬质试管里可能发生的化学方程式,(按甲烷与氧化铜物质的量之比4:7)
(5)过一段时间,打开图2的a、b弹簧夹,I、II中观察到现象是。
(普通班做)
下图中的实验装置可以用于实验室制取乙炔。请填空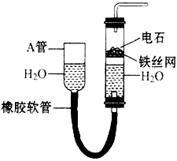
(1)图中,A管的作用是____________。制取乙炔的化学反应方程式为____________。
(2)乙炔通入酸性KMnO4溶液中,发生____________反应,可以观察到____________现象。
(3)乙炔燃烧的化学方程式为________________________,点燃乙炔前应该先________________________。
碘在科研与生活中有重要应用。某兴趣小组用0.50mol·L-1KI、0.2%淀粉溶液、0.20mol·L-1K2S2O8、0.10mol·L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-═2SO42-+I2(慢),I2+2S2O32-═S4O62-+2I-(快),
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将如何变化?为确保能观察到该现象,S2O32—与S2O82—初始的物质的量需满足的范围为:n(S2O32—):n(S2O82—)。
(2)为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表: 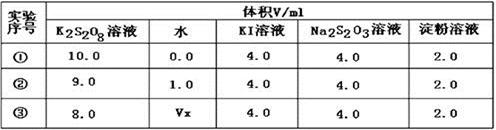

表中Vx=mL,反应速率最快的是(填序号)。
(3)已知图中A曲线为某条件下,浓度c(S2O82—)与反应时间t的变化曲线图,若保持其他条件不变,(填“B”或“C”)曲线为降低反应温度,(填“B”或“C”)曲线为加入催化剂。