电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用。按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)写出FeCl3溶液与铜箔发生反应的化学方程式: 。
(2)检验废腐蚀液中含有Fe3+的实验操作是
(3)“过滤”用到的玻璃仪器有:普通漏斗、 。
(4)废液中加入过量①后,发生反应的离子方程式:
(5)上述流程中取废液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0 mol·L—1、FeCl3 1.0 mol·L—1,若要将铜全部回收,需加入Fe粉的质量应不少于_____________g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于_______________mol。
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。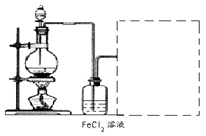
制备Cl2的化学方程式为:
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂。
(共12分)某同学利用以下装置制备氨气并探究氨气的还原性。
实验步骤及现象:①连接仪器并检验装置气密性②通入惰性气体(不与镁反应),排出装置中的空气③打开分液漏斗活塞,观察到B中浓溴水颜色变浅至褪色,C中产生无色气泡④点燃酒精灯,观察E中固体变成了黄绿色。
查阅资料:氮化镁是黄绿色固体,遇水剧烈反应生成两种碱。
请回答下列问题:
(1)A中氢氧化钠的作用为 (用简要的语言和方程式来说明)
(用简要的语言和方程式来说明)
(2)写出B处反应的化学方程式
(3)亚硫酸钠的作用
(4)此装置有不足之处,请说明
(5)某同学要继续探究E中固体成分。将E中的固体放入稀盐酸中,观察到固体溶解并产生气泡,写出此过程中反应的化学方程式
粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物,
进行如下实验:(本题13分)
①. 取适量A进行铝热反应,产物中有单质B生成;
②. 另取20gA全部溶于0.15L6.0mol/L盐酸中,得溶液C;
③. 将①中得到的单质B和溶液C反应,放出1.12L(标况)气体。同时生成溶液D,还残留有固体物质B;
④. 用KSCN溶液检查时,溶液D不变色。
⑴. ①产物中的单质是 ______。该反应的化学方程式为
⑵. ②中所发生的各反应的化学方程式是 _________________;
_________________________。
⑶. ③中所发生的各反应的离子方程式是 _________________;
_________________________。
⑷. 若溶液D的体积仍视为0.15L,则该溶液中c(Mg2+)为 _________
(9分)某同学对第四周期过渡元素产生浓厚的兴趣。想探究是否只有MnO2能催化KClO3受热分解?CuO、Fe2O3、Cr2O3等对氯酸钾的受热分解有没有催化作用?若有催化作用,效率怎样?请你与他一起进行实验探究:
I.课题名称:_________________________。
Ⅱ.实验仪器:略
实验试剂:二氧化锰、氧化铁、氧化铜、氧化铬和氯酸钾
Ⅲ.实验步骤:略
Ⅳ.实验数据:
| 实验 编号 |
KClO3 (g) |
氧化物 |
产生气体(mL) (已折算为标况) |
耗时(s) |
||
| 化学式 |
质量(g) |
回收 |
||||
| 1 |
0.6 |
— |
— |
— |
10 |
480 |
| 2 |
0.6 |
MnO2 |
0.20 |
90% |
67.2 |
36.5 |
| 3 |
0.6 |
CuO |
0.20 |
90% |
67.2 |
79.5 |
| 4 |
0.6 |
Fe2O3 |
0.20 |
90% |
67.2 |
34.7 |
| 5 |
0.6 |
Cr2O3 |
0.20 |
异常 |
67.2 |
188.3 |
V.实验讨论:
⑴请用编号3的实验数据求得KClO3的分解率:为______%(保留一位小数)。
⑵在用Cr2O3做实验时,有刺激性气味的气体产生,同时绿色的混合物变成橘黄色(K2Cr2O7)。该刺激性气体可能是______(填化学式),用检验。(填序号)
A、湿润的蓝色石蕊试纸 B、湿润的碘化钾淀粉试纸
C、湿润的PH试纸 D、湿润的红色石蕊试纸
Ⅵ.实验结论:________________________________________________________。
下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
试回答:
(1)A中所放试剂为,B中所放试剂为,二者反应的化学方程式为,
(2)为得到干燥纯净的氯气,一般在C瓶中加入试剂,D瓶中加入试剂。
(3)E瓶中现象为; F中反应的化学方程式为。
(4)H中应加入的试剂为,其作用是。
其化学方程式为。
实验室用需配制230mL 0.04mol/L的Na2CO3溶液,填空并请回答下列问题:
(1)配制230 mL 0.04mol/L的Na2CO3溶液
| 实际应称Na2CO3质量/g |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次);
A.用30mL水洗涤烧杯2-3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称量取所需的Na2CO3的质量,放入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其完全溶解
C.将已冷却的Na2CO3溶液沿玻璃棒注入一定规格的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1-2cm处
(3)操作C中,溶液注入容量瓶前需恢复到室温,这是因为
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
①若没有进行A操作;
②若加蒸馏水时不慎超过了刻度;
③若定容时俯视刻度线。