X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如右图所示的变化: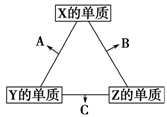
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在元素周期表中的位置是 。
(2)C在一定条件下反应生成A的化学方程式是 。
(3)X、Y、Z三种元素可组成一种强酸W,C能被W溶液吸收生成一种盐,该盐的水溶液的pH小于7,其原因是(用离子方程式表示): 。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,ΔH<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是 (填写各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
e.达到化学平衡后,再升高温度,C的体积分数增大
(1)0.3 mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ的热量,则其热化学方程式为
(2)又已知:H2O(g) =H2O(l) ; ΔH="-44" kJ/mol,则5.6L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是。
现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 |
⑴A基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形。
⑵某同学根据上述信息,所画的B电子排布图如图 ,违背了原理。
,违背了原理。
⑶F位于族区,其基态原子有种运动状态。
⑷CD3 中心原子的杂化方式为,用价层电子对互斥理论推测其分子空间构型为,检验E元素的方法是。
⑸若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为,该单质晶体中原子的堆积方式为四种基本堆积方式中的。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。
室温下,单质A,B,C分别为固体、黄绿色气体、无色气体,在合适反应条件下,它们可以按下图进行反应。又知E溶液是无色的,请回答: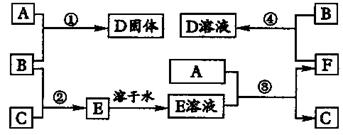
(1)A是、C是 (请填化学式)。
(2)反应①的化学方程式为:。
(3)反应③的化学方程式为:。
(4)反应④的化学方程式为:。
A、B、C、D、E都为短周期元素,A是相对原子质量最小的元素;B的+1价阳离子和C的―1价阴离子都与氖原子具有相同的电子层结构;D在C的下一周期,可与B形成BD型离子化合物;E和C为同一周期元素,其最高价氧化物对应的水化物为一种强酸。请根据以上信息回答下列问题。
(1)B元素在元素周期表中的位置是第______周期______族。
(2)画出D元素的原子结构示意图____________。
(3)A与C形成的化合物中含有化学键的类型是____________。
(4)D的单质与B的最高价氧化物对应的水化物的溶液发生反应的离子方程式为__________________________________________。
二氧化硅晶体是立体的网状结构。其晶体模型如图所示。认真观察晶体模型并回答下列问题:
(1)二氧化硅晶体中最小的环为元环。
(2)每个硅原子为个最小环共有。
(3)每个最小环平均拥有个氧原子。