在密闭容器中发生下列反应aA(g)  cC (g) + dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
cC (g) + dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是( )
| A.A的转化率变大 | B.a < c + d |
| C.平衡向正反应方向移动 | D.D的体积分数变大 |
某原电池总反应为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是()
| A.正极为Cu,负极为Fe,电解质溶液为FeCl3 |
| B.正极为C,负极为Fe,电解质溶液为Fe(NO)3 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3 |
| D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 |
100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度,为了“减缓反应进行的速率,但又不影响生成H2的总量”,可向反应物中加入适量的 ()
| A.Na2CO3溶液 | B.Na2CO3固体 | C.水 | D.NaNO3固体 |
镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述不正确的是()
| A.在化合物中呈+2价 | B.单质能与水反应放出氢气 |
| C.镭比钙的金属性弱 | D.碳酸镭难溶于水 |
已知反应3H2+N2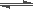 2NH3为放热反应,由此推断出 ()
2NH3为放热反应,由此推断出 ()
| A.氢气和氮气在常温常压下,不需要任何能量就可以迅速发生反应 |
| B.3mol氢气和1mol氮气所具有的总能量低于2mol氨气所具有的总能量 |
| C.断裂1molN≡N键和3molH—H键吸收的能量小于形成6molN—H键所放出的能量 |
| D.氢气和氮气是高能极不稳定的物质,氨气是低能且非常稳定的物质 |
下列叙述中能肯定A金属比B金属金属性强的是 ( )
| A.A原子的最外层电子数比B原子的最外层电子数少 |
| B.A原子的电子层数比B原子的电子层数多 |
| C.1mol A从酸中置换H+生成的H2比1mol B从酸中置换H+生成的H2多 |
| D.常温时,A能从水中置换出氢,而B不能 |