将2×10- 5mol/LKCl 与2×10- 5mol/LAgNO3溶液等体积混合,下列说法正确的是(已知AgCl 的Ksp=1.8×10-10)
| A.有AgCl沉淀析出 | B.无AgCl沉淀 | C.无法确定 | D.有沉淀但不是AgCl |
X、Y、Z、W为短周期元素,它们在周期表中的位置如图所示,若Y原子的最外层电子数是内层电子数的3倍。下列说法中错误的是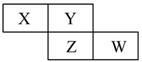
| A.X的氢化物的水溶液显碱性 |
| B.Y和Z只能组成一种化合物 |
| C.Z的氧化物和Z的氢化物分别溶于水后,溶液均呈酸性 |
| D.最高价氧化物对应的水化物的酸性:W>Z |
食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分,下列关于两种物质的说法正确的是
| A.炒菜时放入食盐并不破坏NaCl中的化学键 |
B.HCl的电子式是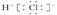 |
| C.NaCl熔化时破坏共价键 |
| D.HCl的结构式是H—Cl |
下列有关说法正确的是
| A.235 92U原子核中含有92个中子 | B.235 92U原子核外有143个电子 |
| C.235 92U与 238 92U互为同位素 | D.235 92U与 238 92U互为同素异形体 |
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表所示:
| 容器编号 |
起始时各物质的物质的量/mol |
达平衡时体系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量:23.15 kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是 ( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为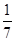
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器 ①的体积为0.5 L,则平衡时放出的热量小于23.15 Kj
已知某温度时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是()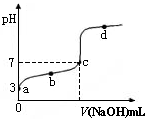
| A.a点时,CH3COOH的电离度是1% |
| B.b点时,溶液中c(CH3COO-)>c(Na+) |
| C.c点表示CH3COOH和NaOH恰好反应完全 |
D.b、d点表示的溶液中 均等于K 均等于K |