A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、C、F的化学式:A ; C ; F ;
(2)写出C溶液和H反应的化学方程式 。
(3)写出下列反应的离子方程式:
① D+盐酸 。② B+水 。
将一定量的CO2气体通入500mL某NaOH溶液中,充分反应后,将溶液在低温进行蒸发,得到不含结晶水的白色固体A。取三份质量不同的A样品分别与50mL相同浓度的盐酸反应,得到气体的体积(标准状况)与固体A的质量关系如下表所示:
| 组别 |
1 |
2 |
3 |
| 盐酸体积(mL) |
50 |
50 |
50 |
| A的质量(g) |
3.80 |
5.70 |
7.60 |
| 气体体积(mL) |
896 |
1344 |
1344 |
(1)上表中第组数据加入的50mL盐酸的反应后有剩余,
(2)试推断:A的成份为
(3)盐酸的物质的量的浓度为mol·L-1
氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)500°C、50Mpa时,在容积为VL的密闭容器中加入n mol N2、3n mol H2,经过t min后反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值
为;t min内用NH3表示的速率是
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)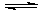 2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为KJ/mol
2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为KJ/mol
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有如下转化关系:(部分反应物、产物及反应条件已略去)。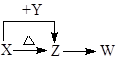
请回答下列问题:
(1)X与Y在水溶液中反应的离子方程式为;
(2)W的结构式为
(3)将Z装入圆底烧瓶,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅱ中的物质由短周期元素组成,装置Ⅲ中产生白色沉淀,装置Ⅴ 中可收集到一种能使带火星木条复燃的气体。装置Ⅱ中物质的化学键类型为 ;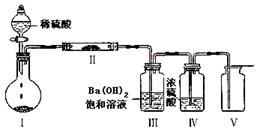
(4)下列关于X、Z的鉴别方法不正确的是
| A.分别加热X、Z的粉末,将产生的气体通入澄清石灰水,观察现象 |
| B.分别将X、Z配成稀溶液,逐滴滴加稀盐酸,观察现象 |
| C.分别将X、Z配成稀溶液,分别加入氯化钙溶液,观察现象 |
| D.分别将X、Z配成稀溶液,分别加入澄清石灰水,观察现象 |
下表给出了五种元素的相关信息,其中A、B、C、D为短周期元素。
| 元素 |
相 关 信 息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料。 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障。 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂。 |
| D |
室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰。 |
| E |
它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等。 |
根据上述信息填空:
(1)E 在元素周期表中的位置是
(2)D的单质与烧碱水溶液加热时自身的氧化还原反应生成两种具有强还原性的阴离子,写出该反应的离子方程式。
(3)C与A形成的化合物X,分子中原子个数比为1∶2;相同条件时,相同质量时,氢气的体积为X气体体积的16倍;分子中有极性键和非极性键,可作火箭燃料。写出X分子的电子式
(4)以上这五种元素能组成一种工业上用途极广的复盐(类似明矾,含一种阴离子和两种阳离子),该物质中的A、B、C、D、E的质量比为5∶56∶7∶16∶14。请写出该化合物的化学式(要求:用离子及分子最简单个数比的形式表达)
现有如下两个反应:
A.2NaOH+H2SO4 = Na2SO4+2H2O B.CH4+2O2 = CO2+2H2O
(1)根据反应的本质,两个反应都为反应(放热或吸热),判断两个反应能否设计为原电池?(填“能或不能”)AB
(2)如果能,最好应选择作电解质溶液(NaOH或H2SO4)。则负极电极反应式:,正极电极反应式:(若均不能则此问不填)