碱金属元素在科学研究和生产生活中有着广泛用途。
(1)锂是最轻的金属,如果用锂做一架飞机,两个人就可以抬动。锂在元素周期表中的表示如图所示,填写以下空格。
①Li在元素周期表中的位置:________。
②6.941的意义:____________________________________。
(2)光电管是利用碱金属铯受到光照射时能形成电流这一光电效应的性质制成的。
①完成铯的原子结构示意图: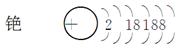
②下列有关铯的说法正确的是________。
| A.其单质在常温下与水反应不如钠剧烈 |
| B.其原子半径比钾原子半径小 |
| C.其氢氧化物的水溶液不能使氢氧化铝溶解 |
| D.其碳酸盐易溶于水 |
实验室常用消石灰和NH4Cl固体混合加热制取氨气,回答下列问题:
(1)写出该反应的化学方程式。
(2)要得到纯净干燥的氨气,可选用的干燥剂是。
| A.浓硫酸 | B.碱石灰 | C.五氧化二磷 | D.固体NaOH |
(3)检验氨气常用的方法是。
有下列四种物质:①SiO2 ②HF ③NaHCO3 ④Na2O2按要求填空(填序号):
(1)常用来作为呼吸面具或潜水艇中供氧剂的是。
(2)可以在玻璃上刻字、雕刻花纹的是。
(3)可以作为食用碱,也是焙制糕点发酵粉的主要成份的是。
(4)由它制成的光导纤维,抗干扰性能好,通信质量高,并且能防窃听,是当前信息社会必不可少的高技术材料,它是。
材料是人类生存、科技发展的重要物质基础。请回答:
(1)玻璃、陶瓷、水泥中除了都含有氧元素外,还都含有(填元素名称或元素符号)元素。
(2)新型镁合金被大量应用于制成笔记本电脑外壳、竞赛自行车框架等,原因是镁合金具有 等优异性能。
A.耐腐蚀B.硬度大C.密度小
(3)塑料、合成橡胶和是常说的三大合成材料。
(4)具有(填“热塑性”或“热固性”)的塑料饮料瓶通过分类、清洗、加热熔融,可重新成为制品。这样做的意义在于(说出一点即可)。
水是一种宝贵的自然资源。改善水质,化学工作者大有作为。请回答:
(1)向源水中加入明矾做混凝剂,可以使水中的悬浮颗粒物沉降。这一过程发生了(填“化学”或“物理”或“既有化学又有物理”)变化。
(2)氯气可用来消毒,这是基于Cl2 + H2O =" HClO" +,产物中
(填化学式)具有强氧化性。
(3)硬水中Ca2+、Mg2+浓度较大,会给生产和生活带来许多不便,生活中可用的方法降低它的硬度。
(4)每年3月22日是世界水日。下列有关说法或做法不符合这一主题的是
A.鼓励使用含磷洗衣粉,使水体富营养化
B.将造纸厂、化工厂建在水源地上游以节约成本
C.合理开发水资源,建立水资源节约设备
我国从1994年起在食盐中添加碘酸钾(KIO3)作为营养强化剂。请回答:
(1)成人如果长期缺碘,会引起的病症是(填字母)。
A.佝偻病 B.甲状腺肿大 C.夜盲症
(2)在瘦肉、胡萝卜、海带中,富含碘元素的是。
(3)依据化学方程式为:5KI+KIO3+6HCl = 6KCl+3I2 +3H2O可检验加碘盐中是否含有碘。此反应中的还原剂是(填化学式),生成的含I2的溶液遇淀粉可变为色。