将1 mol 含镁物质的量分数为a的镁铝合金溶于含有b mol HNO3的稀溶液中,刚好完全反应,NO为唯一还原产物。向所得溶液中逐滴加入NaOH溶液至沉淀不再减少为止,将所得沉淀过滤、洗净、灼烧至恒重,所得固体质量与原合金质量相等。下列说法中正确的是
①合金含镁质量分数为60%②反应中放出气体体积在标准状况下为(1-a/3)× 22.4 L③反应过程中最大沉淀质量为(78-20a)g④反应中共消耗NaOH[b-(1-a/3)]mol
| A.①②③ | B.①②④ | C.①③④ | D.②③④ |
已知在酸性条件下能发生下列反应:Cu+→Cu+Cu2+(未配平)。NH4CuSO3与足量的10 mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成;②有刺激性气味气体产生;③溶液呈蓝色。据此判断下列说法一定合理的是
| A.该反应显示硫酸具有酸性 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.反应中硫酸作氧化剂 |
下列各组物质中,满足下图物质一步转化关系的选项是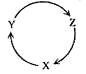
| 选项 |
X |
Y |
Z |
| A |
NO |
NO2 |
HNO3 |
| B |
Cu |
CuSO4 |
Cu(OH)2 |
| C |
C |
CO |
CO2 |
| D |
Si |
SiO2 |
H2SiO3 |
下列离子方程式表达正确的是
A.硫化钠的水解反应:S2—+2H2O  H2S+2OH— H2S+2OH— |
| B.铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ |
C.在硫酸亚铁溶 液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O 液中通入氧气:4Fe2++O2+4H+=4Fe3++2H2O |
| D.向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O=HClO+HSO3- |
下列现象或事实可用同一化学原理加以说明的是
| A.氯化铵和碘都可以用加热法进行提纯 |
| B.氯水和二氧化硫气体均能使品红溶液褪色 |
| C.硫酸亚铁溶液和氢氧化钠溶液在空气中久置后均会变质 |
| D.铁片和铝片置于冷的浓硫酸中均无明显现象 |