常温下,在0.1 mol·L-1的CH3COOH溶液中,水的离子积是 ( )
| A.1×10-14 | B.1×10-13 | C.1.32×10-14 | D.1.32×10-15 |
下列物质分别与NaOH的醇溶液共热后,能发生消去反应,且生成只有一种的是
A.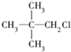 |
B.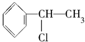 |
| C.CH3Cl | D.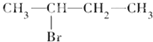 |
化合物丙由如下反应制得: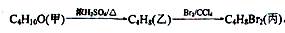
丙的结构简式不可能是
| A.CH3CH2CHBrCH2Br | B.CH3CH(CH2Br)2 |
| C.CH3CHBrCHBrCH3 | D.(CH3)2CBrCH2Br |
要检验己烯中是否含有少量甲苯,正确的实验方法是
| A.先加足量溴水,然后再加入酸性高锰酸钾溶液 |
| B.先加足量的酸性高锰酸钾溶液,然后再加入溴水 |
| C.点燃这种液体,然后再观察火焰的颜色 |
| D.加入浓硫酸与浓硝酸后加热 |
某烯烃氢化后得到的饱和烃是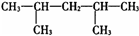 ,则原烯烃可能有的结构简式有
,则原烯烃可能有的结构简式有
| A.1种 | B.2种 | C.3种 | D.4种 |
下列有机化合物命名正确的是
①1-甲基丙烷②3,4-二甲基戊烷 ③2-乙基丁烷 ④3-乙基-2-甲基戊烷
| A.只有②③ | B.只有③④ | C.都正确 | D.都错误 |