已知:(NH4)2CO3(s)====NH4HCO3(s)+NH3(g) ΔH="+74.9" kJ·mol-1,下列说法中正确的是( )
| A.该反应中熵变小于0,焓变大于0 |
| B.该反应是吸热反应,因此一定不能自发进行 |
| C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |
| D.判断反应能否自发进行需要根据ΔH与ΔS综合考虑 |
短周期元素组成的物质Q,发生如下反应:Q R+T+H2O,下列说法正确的是()
R+T+H2O,下列说法正确的是()
| A.Q一定含三种元素 | B.Q一定不是碱 |
| C.Q一定含有金属元素 | D.R与T中一定有一种盐 |
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒。其中ClO-的物质的量随时间变化的曲线如图所示。下列判断不正确的是()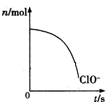
| A.反应的氧化剂是ClO- |
| B.消耗1mol还原剂,转移电子3mol |
| C.氧化剂与还原剂的物质的量之比为2:3 |
| D.反应后溶液的酸性明显增强 |
短周期主族元素X、Y、Z、W的原子序数依次增大。X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z+与Y2-具有相同的电子层结构,W与Y同族。下列说法正确的是()
| A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B.Z在周期表中的位置为第3周期、IB族 |
| C.W比Y更容易与氢气反应 |
| D.X的最高价氧化物对应水化物的酸性比W的弱 |
下列叙述错误的是()
①热稳定性:H2O>HF>H2S②熔点:Al>Na>K ③ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素⑤多电子原子中,在离核较近的区域内运动的电子能量较高⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq)△H=-114.6kJ•mol-1 则中和热为57.3kJ•mol-1⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键
| A.①⑤⑦ | B.①⑤⑥ | C.②③④ | D.②④⑥ |
“保护环境,就是保护人类自己。”下列环境问题与其产生的主要原因不相符的是()
①“臭氧空洞”主要是大量使用氟氯代烃等引起的
②“光化学烟雾”主要是由NOx等引起的
③“赤潮”主要是由水体中P、N等元素过量引起的
④“白色污染”主要是由聚乙烯塑料等引起的
⑤“酸雨”主要是由空气中CO2浓度增大引起的
⑥“温室效应”主要是由空气中CO2浓度增大引起的
| A.只有⑤ | B.只有②③⑤ | C.只有① | D.全部 |