标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g/mL),所得溶液的密度为ρ g/mL,质量分数为w,物质的量浓度为c mol/L,则下列关系式中不正确的是 ( )
| A.c=1 000Vρ/(17V+22 400) | B.w=17c/(1 000ρ) |
| C.w=17V/(17V+22 400) | D.ρ=(17V+22 400)/(22.4+22.4 V) |
下列化合物中,既显酸性又能发生加成反应的是:
| A.CH2=CH—CH2OH | B.CH3COOH |
| C.CH2=CH—COOC2H5 | D.CH2=CH—COOH |
酒精和醋酸是生活里的常用品,下列方法不能将二者鉴别开的是:
| A.闻气味 |
| B.分别用来浸泡水壶中的水垢看是否溶解 |
| C.分别滴加NaOH溶液 |
| D.分别滴加石蕊试液 |
将浓溴水加入苯中,经充分振荡、静置后、溴水层的颜色变浅,这是因为发生了:
| A.加成反应 | B.萃取作用 |
| C.取代反应 | D.氧化反应 |
制取乙酸乙酯的装置正确的是(其中B和D的玻璃导管是插入到小试管内的液面下)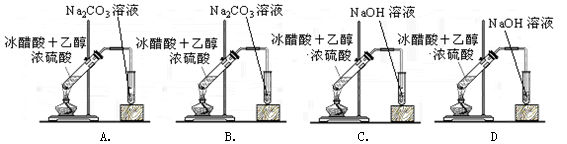
制取一氯乙烷最好采用的方法是:
| A.乙烷和氯气反应 | B.乙烯和氯气反应 |
| C.乙烯和氯化氢反应 | D.乙烯和氯气、氢气反应 |