已知有以下物质相互转化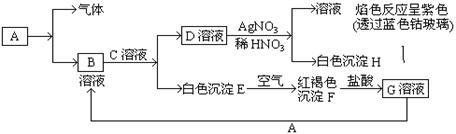
试回答:(1)写出B的化学式 ,D的化学式 。
(2)写出由E转变成F的化学方程式 。
(3)写出F转化成G的离子方程式 ;
完成下列化学方程式(8分)
(1) 与足量金属钠发生反应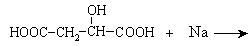
(2) 与NaOH的醇溶液共热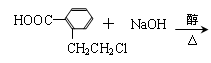
(3) 葡萄糖和新制Cu(OH)2及NaOH共热
(4)与足量H2反应
OHC-CH=CH-COOH+H2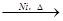
(12分):【化学——物质结构与性质】
A、B、C、D、E都是元素周期表中前20号元素,其原子序数依次增大。B、C、D同周期,A、D同主族,E和其它元素既不在同周期也不在同主族。B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,D的原子半径是同周期原子中最小的。
根据以上信息,回答下列问题:
(1)上述A、B、C、D四种元素中第一电离能最小的是,电负性最大的是,原子半径由小到大的顺序为。 (填相关元素的元素符号)
(2)A和D的氢化物中,沸点较高的是(填相关物质的分子式);其原因是。
(3)A和E可形成离子化合物,其晶胞结构如图所示:则每个晶胞中含阳离子的数目为,含阴离子的数目为,该离子化合物的化学式为。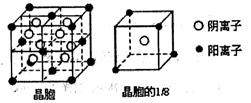
(12分)【化学——化学与技术】
海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)多级闪蒸法是目前“海水淡化”的主要技术。该法是在一定条件下将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水。由此可判断多级闪蒸法是(填“物理变化” 或“化学变化”)。
(2)利用海水晒盐的原理是;分离食盐晶体后的母液中含有KCl、MgCl2,经过分离、提纯后,可用于。
(3)“氯碱工业”利用电解饱和食盐水制得重要化工产品。在氯碱工业中,隔膜法电解(如图甲所示)工艺逐渐被离子交换膜电解(如图乙所示)技术取代。
①写出两电极的反应式:阳极,阴极。
②石棉隔膜的作用是。离子交换膜电解槽中⑥、⑦分别是、。
(18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是,该反应将太阳能转化为。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。
①电解过程中发生反应的离子方程式是,阴极附近溶液PH(填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式。
③图中氢氧化钠溶液的质量分数a%b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为。
(16分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g)
2NH3(g) H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡移动、(填“向左”、“向右”或“不”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(H2)=。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据:
①则该反应△H0,表中数据ad,bf(均选填“>”、‘‘=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理。