(16分)合成氨技术的发明使工业化人工固氮成为现实。
(1)已知N2(g)+3H2(g) 2NH3(g)
2NH3(g)  H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
H=-92.2kJ·mol-1。在一定条件下反应时,当生成标准状况下33.6LNH3时,放出的热量为 。
(2)合成氨混合体系在平衡状态时NH3的百分含量与温度的关系如下图所示。由图可知:
①温度T1、T2时的平衡常数分别为K1、K2,则K1 K2 (填“>”或“<”)。若在恒温、恒压条件下,向平衡体系中通入氦气,平衡 移动、(填“向左”、“向右”或“不”)。
②T2温度时,在1L的密闭容器中加入2.1mol N2、l.5molH2,经10min达到平衡,则v(H2)= 。达到平衡后,如果再向该容器内通入N2、H2、NH3各0.4mol,则平衡 移动(填“向左”、“向右”或“不”)。
(3)工业上用CO2和NH3反应生成尿素:CO2(g)+2NH3(g) H2O(1)+CO(NH2)2(1) △H,
H2O(1)+CO(NH2)2(1) △H,
在一定压强下测得如下数据:
①则该反应△H 0,表中数据a d,b f(均选填“>”、‘‘=”或“<”)。
②从尿素合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下: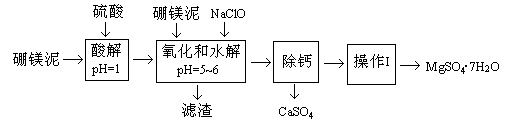
根据题意回答下列问题:
(1)实验中需用1mol/L的硫酸80mL,若用98%的浓硫酸来配制,除量筒、玻璃棒外,还需要的玻璃仪器有。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式。在调节pH=5-6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为。
(4)如何检验滤液中Fe3+是否被除尽,简述检验方法。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤、。
(6)如果提供的硼镁泥共100 g,得到的MgSO4·7H2O 196.8 g,则MgSO4·7H2O的产率为。
工业上制取铝的流程如下:
注:冰晶石的作用是使E在较低温度下熔化。
(1)试写出下列物质的化学式:
A,B,C,D,E。
(2)在用此法制取铝时,分析铝土矿和赤泥(提取Al2O3之后的残渣)所得数据如下:
| Al2O3 |
Fe2O3 |
Na2O |
|
| 铝土矿 |
55% |
16% |
0% |
| 赤泥 |
15% |
48% |
8% |
试求制取1t Al2O3所需铝土矿和苛性钠的质量。(写过程)
仔细体会下列有机合成过程中碳骨架的构建及官能团的引入和转化,完成下题:
已知两个醛分子在NaOH溶液作用下可以发生加成反应,生成一种羟基醛:
肉桂醛F(分子式为C9H8O)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如下路线合成的:
已知:反应⑤为羟醛缩合反应。请回答:
(1)肉桂醛F的结构简式为:。E中含氧官能团的名称为。
(2)反应①~⑥中符合原子经济性的是。
(3)写出下列转化的化学方程式:②,③。
写出有关反应的类型:②⑥。
(4)符合下列要求的E物质的同分异构体有种(苯环上有两个取代基,其中有一个甲基在对位且属于酯类)。
现有FeCl3、AlCl3的混合溶液100mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量(mol)的关系如图
计算
(1)a处沉淀的总物质的量mol
(2)c(FeCl3)=mol/L
(3)c(AlCl3)=mol/L
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-.将这四种溶液分别标记为A、B、C、D,进行实验:
①在A或D中滴入C,均有沉淀生成;②D和B反应生成的气体能被A吸收;
③A和D反应生成的气体能被B吸收.试回答下列问题:
(1)D的化学式是________,判断理由是______________________________
(2)写出其余几种物质的化学式:A________,B________,C________.
(3)写出实验②中有关反应的离子方程式___________________________.