下列说法正确的是
①常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
②为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
③相同温度下,将足量氯化银固体分别放入相同体积的a.蒸馏水 b.0.1 mol·L—1盐酸、
c.0.1 mol·L—1氯化镁溶液 d.0.1 mol·L—1硝酸银溶液中,Ag+浓度:a>d=b>c
④用0.2000 mol·L—1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合液中两种酸的浓度均约为0.1 mol·L—1),至中性时,溶液中的酸未被完全中和
⑤将水加热到120℃,pH=6:c(OH-)< c(H+)
⑥醋酸与醋酸钠的pH=7的混合溶液中:c(CH3COO-)> c(Na+)
⑦0.lmoI·L-1的硫酸铵溶液中:c(NH4+)> c(SO42-)> c(H+)
⑧pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)= c(H+)
| A.③⑤ | B.①⑧ | C.④⑦ | D.②⑥ |
在进行中和热的测定中,下列说法错误的是
| A.反应前酸、碱溶液的温度要相同 |
| B.测量混合后溶液的温度计要一直插在溶液中 |
| C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸) |
| D.NaOH稍过量的目的是保证盐酸完全被NaOH中和 |
对于反应COCl2(g) CO(g)+Cl2(g) ΔH=-QkJ·mol-1(Q>0)化学平衡常数为K 则下列叙述正确的是:
CO(g)+Cl2(g) ΔH=-QkJ·mol-1(Q>0)化学平衡常数为K 则下列叙述正确的是:
| A.一定条件下,该反应在任何温度下均能自发进行 |
B.反应CO(g)+Cl2(g)  COCl2(g) ΔH=" +Q" kJ·mol-1化学平衡常数为K COCl2(g) ΔH=" +Q" kJ·mol-1化学平衡常数为K |
C.反应2COCl2(g) 2CO(g)+2Cl2(g) 化学平衡常数为2K 2CO(g)+2Cl2(g) 化学平衡常数为2K |
| D.将1mol COCl2 (g)置于一密闭容器中充分反应后放出QkJ的热量 |
对已达化学平衡的下列反应 2X(g)+Y(g) 2Z(g),减小压强时,对反应产生的影响是:
2Z(g),减小压强时,对反应产生的影响是:
| A.逆反应速率增大,正反应速率减小 |
| B.逆反应速率减小,正反应速率增大 |
| C.逆反应速率先增大后减小 |
| D.正反应速率先减小后增大 |
下列说法错误的是:
| A.工业上采用电解熔融氯化铝制取金属铝 |
| B.牺牲阳极的阴极保护法实际上是利用原电池原理 |
| C.将钢闸门与外电源负极相连,可防止其腐蚀 |
| D.铅蓄电池充电时,铅电极与直流电源的负极相接 |
将反应Cu(s)+2Ag+(aq)===Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,下列有关叙述正确的是: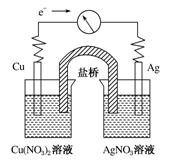
| A.KNO3盐桥中的K+移向Cu(NO3)2溶液 |
| B.Cu作负极,发生还原反应 |
| C.电子由AgNO3溶液通过盐桥移向Cu(NO3)2溶液 |
| D.工作一段时间后,AgNO3溶液中c(Ag+)减小 |